题目内容
【题目】科学家一直致力于“人工固氮”的方法研究。
(1)合成氨的原理为:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)![]() H=-92.4 kJ/mol,该反应的能量变化如图所示。
H=-92.4 kJ/mol,该反应的能量变化如图所示。
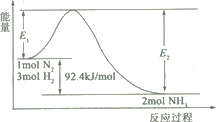
①在反应体系中加入催化剂,反应速率增大,E2的变化是___(填“增大”、“减小”或“不变”)。
②将0.3 mol N2和0.5 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的![]() ,此时H2的转化率为___;欲提高该容器中H2的转化率,下列措施可行的是___(填选项字母)。
,此时H2的转化率为___;欲提高该容器中H2的转化率,下列措施可行的是___(填选项字母)。
A.向容器中按原比例再充入原料气 | B.向容器中再充入一定量H2 |
C.改变反应的催化剂 | D.液化生成物分离出氨 |
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:
2N2(g)+6H2O(1)![]() 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)![]() H=+1530 kJ/mol
H=+1530 kJ/mol
又知:H2O(1)=H2O(g)![]() H=+44.0 kJ/mol
H=+44.0 kJ/mol
则2N2(g)+6H20(g)![]() 4NH3(g)+302(g)
4NH3(g)+302(g)![]() H =___kJ/mol,该反应的化学平衡常数表达式为K=_______,控制其他条件不变,增大压强,K值___(填“增大”、“减小”或“不变”)。
H =___kJ/mol,该反应的化学平衡常数表达式为K=_______,控制其他条件不变,增大压强,K值___(填“增大”、“减小”或“不变”)。
【答案】减小 30% A D +1266  不变
不变
【解析】
(1)①在反应体系中加入催化剂,活化能降低,E2也减小,反应速率增大。
② N2+ 3H22NH3
起始 0.3 mol 0.5 mol 0
转化 x mol 3x mol 2x mol
平衡 (0.3-x)mol (0.5-3x)mol 2x mol
根据题意有(0.3-x)mol +(0.5-3x)mol+ 2x mol=0.7,解得x=0.05,H2转化0.15 mol,转化率为30%。
欲提高转化率可以按原比例向容器中再充入原料气(相当于加压),液化生成物分离出氨,也可以降温。
(2)由盖斯定律消去H2O(l)可得,2N2(g) + 6H2O(g)![]() 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)
ΔH =+1266 kJ·mol-1。
该反应的平衡常数表达式可以表示为K= K只受温度的影响,控制其他条件不变,增大压强,K值不变
K只受温度的影响,控制其他条件不变,增大压强,K值不变

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】现有部分短周期元素的原子结构如下表:
元素符号 | 元素原子结构 |
X | 原子结构示意图为 |
Y | 最外层电子数是次外层电子数的2倍 |
Z | 原子核内含有12个中子,且其离子的结构示意图为 |
(1)写出X的元素符号:________,元素Y的最简单氢化物的化学式为_________。
(2)Z元素原子的质量数为_______。
(3)X和Z两种元素的最高价氧化物对应的水化物相互反应的离子方程式为______________________