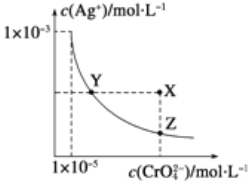
题目内容
【题目】某研究性学习小组欲探究原电池的形成条件,按下图所示装置进行实验
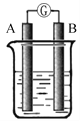
序号 | A | B | 烧杯中的液体 | 指针是否偏转 |
1 | Zn | Cu | 稀硫酸 | 有 |
2 | Zn | Zn | 稀硫酸 | 无 |
3 | Cu | C | 氯化钠溶液 | 有 |
4 | Mg | Al | 氢氧化钠溶液 | 有 |
分析上述数据,回答下列问题:
(1)实验1中电流由________极流向_______ 极(填“A”或“B”)
(2)实验4中电子由B极流向A极,表明负极是_________电极(填“镁”或“铝”)
(3)实验3 表明 ______
A.铜在潮湿空气中不会被腐蚀 B.铜的腐蚀是自发进行的
(4)分析上表有关信息,下列说法不正确的是____________
A.相对活泼的金属一定做负极
B.失去电子的电极是负极
C.烧杯中的液体,必须是电解质溶液
D.浸入同一电解质溶液中的两个电极,是活泼性不同的两种金属(或其中一种非金属)
【答案】B A 铝 B A
【解析】
本实验的目的是探究原电池的形成条件。原电池的必备构造:①有两个活性不同的电极②两个电极由导线连接,并插入到电解质溶液中,形成电流回路③能自发的进行氧化还原反应;以此答题。
(1)Zn的活泼性比Cu强,则Zn作负极,Cu作正极,则电子由Zn电极从外电路向Cu电极移动,即电子由A极向B极移动,则电流由B极向A极移动;
(2)实验四中,电子由B极向A极移动,则B极失去电子,作负极,即负极为铝电极;
(3)实验三中,指针发生偏转,说明有电流移动,即电子也有移动,则说明该过程是自发进行的氧化还原反应,故合理选项为B;
(4)A. 相对活泼的金属一般作负极,但是也有例外,比如实验四,镁的活泼性比铝强,但是镁不和氢氧化钠溶液反应,铝可以,所以铝作负极,A错误;
B. 负极发生氧化反应,对应的物质是还原剂,失去电子,B正确;
C. 烧杯中的液体必须是电解质溶液,以构成电流回路,C正确;
D. 浸入同一电解质溶液中的两个电极,必须是活泼性不同的两种金属(或其中一种非金属),D正确;
故合理选项为A。

【题目】某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于25μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)PM2.5分散在空气中形成的分散系___(填“属于”,“不属于”)胶体。
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度(mol/L) | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断待测试样为___(填酸”、“碱”)性,表示该试样酸碱性的c(H+)或c(OH-)=_______mol/L。
(3)煤燃烧排放的烟气含有SO2和NOx,形成酸雨,污染大气,采用NaClO2溶液在碱性条件下可对烟气进行脱硫,脱硝,效果非常好。完成下列对烟气脱硝过程的离子方程式。
___ClO2-+__NO+____=___Cl-+___NO3-+___,________________
(4)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。写出焦炭与水蒸气反应的化学方程式___________。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是___________。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(5)汽车尾气中NOx和CO的生成及转化。
①汽车启动后,汽缸温度越高,单位时间内NO排放量越大,写出汽缸中生成NO化学方程式_______________。
②汽车燃油不完全燃烧时产生CO,目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为_______________。