题目内容
【题目】某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于25μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)PM2.5分散在空气中形成的分散系___(填“属于”,“不属于”)胶体。
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度(mol/L) | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断待测试样为___(填酸”、“碱”)性,表示该试样酸碱性的c(H+)或c(OH-)=_______mol/L。
(3)煤燃烧排放的烟气含有SO2和NOx,形成酸雨,污染大气,采用NaClO2溶液在碱性条件下可对烟气进行脱硫,脱硝,效果非常好。完成下列对烟气脱硝过程的离子方程式。
___ClO2-+__NO+____=___Cl-+___NO3-+___,________________
(4)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。写出焦炭与水蒸气反应的化学方程式___________。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是___________。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(5)汽车尾气中NOx和CO的生成及转化。
①汽车启动后,汽缸温度越高,单位时间内NO排放量越大,写出汽缸中生成NO化学方程式_______________。
②汽车燃油不完全燃烧时产生CO,目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为_______________。
【答案】 不属于 酸 10-4 3ClO2-+4NO+4OH-=3Cl-+4NO3-+2H2O C+H2O(g) ![]() CO+H2 a、b N2+O2
CO+H2 a、b N2+O2![]() 2NO 2CO+2NO
2NO 2CO+2NO![]() 2CO2+N2
2CO2+N2
【解析】(1)PM2.5的直径小于2.5×10-5m,所以分散在空气中形成的分散系不属于胶体。(2)根据电荷守恒得:c(H+)+c(K+)+c((Na+)+c(NH4+)=2c(SO42-)+c(NO3-)+c(Cl-),将表中数据带入得:c(H+)=10-4 mol/L,所以待测试样显酸性;(3)N元素化合价从+2价升高到+5价,失去3个电子,Cl元素化合价从+3价降低到-1价,得到4个电子,根据电子得失守恒可知反应的方程式为3ClO2-+4NO+4OH-3Cl-+4NO3-+2H2O;(4)①焦炭与水蒸气反应的化学方程式为C+H2O(g)![]() CO+H2。②二氧化硫是酸性氧化物,所以具有酸性氧化物的通性能够与碱反应:SO2+Ca(OH)2=CaSO3↓+H2O;二氧化硫水溶液是亚硫酸,所以也能够与碳酸钠反应:SO2+Na2CO3=Na2SO3+CO2↑,与氯化钙、亚硫酸氢钠不反应,因此可以用氢氧化钙溶液和碳酸钠溶液做洗涤剂,答案选ab;(5)①汽缸中生成NO化学方程式为N2+O2
CO+H2。②二氧化硫是酸性氧化物,所以具有酸性氧化物的通性能够与碱反应:SO2+Ca(OH)2=CaSO3↓+H2O;二氧化硫水溶液是亚硫酸,所以也能够与碳酸钠反应:SO2+Na2CO3=Na2SO3+CO2↑,与氯化钙、亚硫酸氢钠不反应,因此可以用氢氧化钙溶液和碳酸钠溶液做洗涤剂,答案选ab;(5)①汽缸中生成NO化学方程式为N2+O2![]() 2NO。②CO和NO催化氧化生成氮气和二氧化碳,反应的化学方程式为2CO+2NO
2NO。②CO和NO催化氧化生成氮气和二氧化碳,反应的化学方程式为2CO+2NO![]() 2CO2+N2。
2CO2+N2。

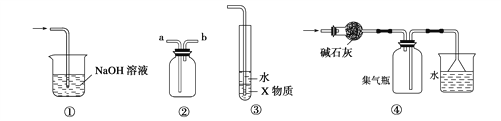
【题目】I、硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验并回答:
如图1所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c 三个棉球变化如下表(认为所产生的气体与棉球上的试剂均得到充分的反应)。则浓硫酸在该反应中表现的性质_________________;
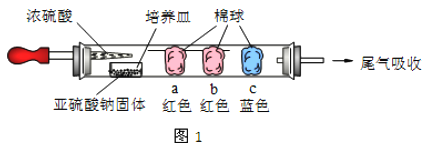
棉球 | 棉球上滴加试剂 | 实验现象 | 解释或结论 |
a | ___________ | 棉球变白,微热后又恢复红色 | 该气体具有______性。 |
b | 含酚酞的NaOH 溶液 | 棉球变为白色 | 离子方程式_________ |
c | __________ | 棉球变为白色 | 化学方程式___________,该气体具有_______性。 |
II.通常情况下,向硫酸亚铁溶液中滴加氢氧化钠溶液时,生成的白色絮状沉淀会迅速变为_____色,最终变为____色写出上述白色絮状沉淀变化过程的化学方程式_______;
用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一: 用不含O2的蒸馏水配制的NaOH 溶液与硫酸亚铁反应制备。
(1)除去蒸馏水中溶解的O2常采用_________的方法。
(2)生成白色Fe(OH)2 沉淀的操作是用长滴管吸取不含O2的NaOH 溶液,插入FeSO4溶液液面下,再挤出NaOH 溶液。
方法二: 如右图装置中,用NaOH 溶液、铁屑、稀H2SO4等试剂制备。
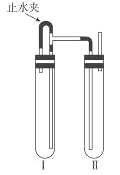
(1)在试管I里加入的试剂是___________。
(2)为了制得白色Fe(OH)2沉淀,在试管I和II中加入试剂,打开止水夹,塞紧塞子后,检验试管II出口处排出的氢气的纯度。当排出的氢气纯净时,再________(如何操作)。这样生成的Fe(OH)2 沉淀能较长时间保持白色。原因是____________。