题目内容
【题目】把1molX气体和1molY气体混合于2L密闭容器中,发生如下反应:
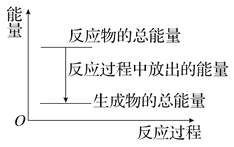
3X(g)+2Y(g)![]() nZ(g)+2W(g) △H<0,2min末反应达到平衡状态,此时测得生成0.1 mol·L-1 W,以Z的变化量表示的平均反应速率为0.1 mol·L-1·min-1。
nZ(g)+2W(g) △H<0,2min末反应达到平衡状态,此时测得生成0.1 mol·L-1 W,以Z的变化量表示的平均反应速率为0.1 mol·L-1·min-1。
请完成下列问题:
(1)n= ____________。
(2)2min末时Y的转化率_________。
(3)起始容器内压强与平衡时容器内压强之比_________。
(4)已知:可逆反应达到平衡状态后,若改变影响平衡的一个外界条件(如温度、浓度、压强等),平衡将向着减弱这种改变的方向移动。下列条件变化,既能加快反应速率又能使平衡向正反应方向移动的是_________(填选项字母)。
a.升高温度 b.再充入1molX气体 c.增大容器容积
【答案】4 20% 20/21 b
【解析】
列出三段式进行分析。
3X(g)+2Y(g)![]() nZ(g)+2W(g)
nZ(g)+2W(g)
起始浓度mol·L-1 0.5 0.5 0 0
变化浓度mol·L-1 0.15 0.1 0.2 0.1
平衡浓度mol·L-1 0.35 0.4 0.2 0.1
(1)根据速率之比等于化学计量数之比计算n的值.
(2)Y的转化率=反应的Y物质的量/Y起始物质的量×100%;
(3)起始容器内压强与平衡时容器内压强之比=起始容器内总物质的量与平衡时容器内总物质的量之比;
(4)3X(g)+2Y(g)![]() 4Z(g)+2W(g) △H<0是气体体积增大的放热反应,以此分析。
4Z(g)+2W(g) △H<0是气体体积增大的放热反应,以此分析。
2min末反应达到平衡状态,此时测得生成0.1 mol·L-1 W,以Z的变化量表示的平均反应速率为0.1 mol·L-1·min-1,Z平衡浓度为0.1 mol·L-1·min-1×2min=0.2 mol·L-1。列出三段式:
3X(g)+2Y(g)![]() nZ(g)+2W(g)
nZ(g)+2W(g)
起始浓度mol·L-1 0.5 0.5 0 0
变化浓度mol·L-1 0.15 0.1 0.2 0.1
平衡浓度mol·L-1 0.35 0.4 0.2 0.1
(1)根据速率之比等于化学计量数之比计算n的值。
速率之比等于化学计量数之比,0.2mol/(L·min):0.1mol/(L·min)=n:2,解得n=4;
(2)Y的转化率=反应的Y物质的量/Y起始物质的量×100%=0.1mol/0.5mol×100%=20%;
(3)起始容器内压强与平衡时容器内压强之比=起始容器内总物质的量与平衡时容器内总物质的量之比=(0.5+0.5):(0.35+0.4+0.2+0.1)=20:21;
(4)3X(g)+2Y(g)![]() 4Z(g)+2W(g) △H<0是气体体积增大的放热反应,
4Z(g)+2W(g) △H<0是气体体积增大的放热反应,
a.升高温度平衡逆向进行,故不符;
b.再充入1molX气体,既能加快反应速率又能使平衡向正反应方向移动,故符合;
c.增大容器容积,减慢反应速率,能使平衡向正反应方向移动,故不符;
故选b。