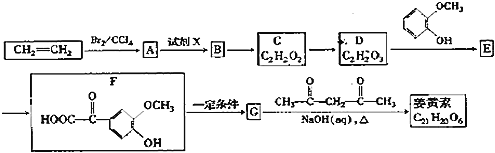
题目内容
【题目】二氧化氯是高效、低毒的消毒剂。已知:ClO2是一种黄绿色易溶于水的气体,具有强氧化性,回答下列问题:
(1)ClO2的制备及性质探究装置如图:

①仪器a的名称为___,装置B的作用是___。
②装置C用于制备ClO2,同时还生成一种酸式盐,该反应的化学方程式为___。装置D的作用是___。
③ClO2可用于处理碱性含硫废水(硫被氧化为最高价态),ClO2与Na2S溶液反应的离子方程式为___。
④装置E用于吸收尾气,反应可得NaClO2溶液。已知NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO23H2O,在温度高于38℃时析出的晶体是NaClO2。请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
ⅰ.___;
ⅱ.___;
ⅲ.洗涤;
ⅳ.干燥。
(2)测定生成ClO2的质量
实验步骤如下:
a.取下装置D,将其中的溶液转入250mL容量瓶,用蒸馏水洗涤装置D2~3次,并将洗涤液一并转移到容量瓶中,加蒸馏水稀释至刻度。
b.从容量瓶中取出25.00mL溶液于锥形瓶中,用0.1000molL-1硫代硫酸钠标准溶液滴定(2Na2S2O3+I2=Na2S4O6+2NaI),指示剂显示终点时消耗硫代硫酸钠溶液24.00mL。
①滴定至终点的现象是___。
②进入装置D中的ClO2的质量为___。
③若滴定开始仰视读数,滴定终点时正确读数,则测定结果___(填偏高偏低或不变)。
【答案】分液漏斗 安全瓶(或防堵塞) SO2+H2SO4+2KClO3=2KHSO4+2ClO2 检验有I2生成,进而证明ClO2具有强氧化性 8ClO2+5S2-+8OH-=8Cl-+5SO42-+4H2O 加热浓缩,冷却至38℃以上结晶 趁热过滤 溶液由蓝色变为无色,且半分钟内不恢复原色 0.324g 偏低
【解析】
(1)①浓硫酸和亚硫酸钠反应生成SO2,A制备SO2,B装置有缓冲作用,能防止倒吸、堵塞;
②装置C用制备ClO2,同时生成一种酸式盐,则C中发生反应SO2+H2SO4+2KClO3=2KHSO4+2ClO2,ClO2是一种黄绿色易溶于水的气体,具有强氧化性,能将I-氧化成I2,淀粉变蓝;
③根据信息,ClO2具有强氧化性,能将Na2S中S氧化成SO42-,则本身被还原成Cl-,据此书写反应方程式;
④从溶液中制得NaClO2晶体,根据信息,需要温度高于38℃,因此操作步骤是蒸发浓缩,冷却至38℃以上结晶,然后趁热过滤,洗涤,干燥;
(2)①根据根据题意,终点现象是溶液由蓝色变为无色,且30s内不恢复原来的颜色;
②根据信息,判断出ClO2-5S2O32-的关系式,然后据此分析。
(1)![]() 仪器a的名称为分液漏斗,装置B的作用是安全瓶
仪器a的名称为分液漏斗,装置B的作用是安全瓶![]() 或防堵塞
或防堵塞![]() ,故答案为:分液漏斗;安全瓶
,故答案为:分液漏斗;安全瓶![]() 或防堵塞
或防堵塞![]() ;
;
![]() 装置C用于制备
装置C用于制备![]() ,通入
,通入![]() 与氯酸钾、硫酸反应生成
与氯酸钾、硫酸反应生成![]() ,同时还生成一种酸式盐
,同时还生成一种酸式盐![]() ,该反应的化学方程式为:
,该反应的化学方程式为:![]() ;装置D的作用是:通过检验有
;装置D的作用是:通过检验有![]() 生成,进而证明
生成,进而证明![]() 具有强氧化性,故答案为:
具有强氧化性,故答案为:![]() ;检验有
;检验有![]() 生成,进而证明
生成,进而证明![]() 具有强氧化性;
具有强氧化性;
![]() 可用于处理碱性含硫废水
可用于处理碱性含硫废水![]() 硫被氧化为最高价态
硫被氧化为最高价态![]() ,Cl被还原为低价态,
,Cl被还原为低价态,![]() 与
与![]() 溶液反应的离子方程式为:
溶液反应的离子方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
![]() 从
从![]() 溶液中制得
溶液中制得![]() 晶体,为了制得
晶体,为了制得![]() 在温度高于
在温度高于![]() 时析出晶体,
时析出晶体,![]() 加热浓缩,冷却至
加热浓缩,冷却至![]() 以上结晶;
以上结晶;![]() 趁热过滤;
趁热过滤;![]() 洗涤;
洗涤;![]() 干燥,故答案为:加热浓缩,冷却至
干燥,故答案为:加热浓缩,冷却至![]() 以上结晶;趁热过滤;
以上结晶;趁热过滤;
(2)![]() 与KI反应产生
与KI反应产生![]() ,碘遇淀粉反应变蓝,加入硫代硫酸钠滴定消耗掉碘单质,蓝色消失,故滴定终点的现象为:溶液由蓝色变为无色,且半分钟内不恢复原色,故答案为:溶液由蓝色变为无色,且半分钟内不恢复原色;
,碘遇淀粉反应变蓝,加入硫代硫酸钠滴定消耗掉碘单质,蓝色消失,故滴定终点的现象为:溶液由蓝色变为无色,且半分钟内不恢复原色,故答案为:溶液由蓝色变为无色,且半分钟内不恢复原色;
![]() ;
;![]() ;
;![]() ;
;![]() ,
,![]() ,故答案为:
,故答案为:![]() ;
;
![]() 若滴定开始仰视读数,滴定终点时正确读数,初始标准液体积读数偏大,标准液体积偏小,则测定结果偏低,故答案为:偏低。
若滴定开始仰视读数,滴定终点时正确读数,初始标准液体积读数偏大,标准液体积偏小,则测定结果偏低,故答案为:偏低。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案【题目】某同学探究Cu与NO的反应,查阅资料:①Cu与NO反应可生成CuO和N2,②酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
(1)实验室利用Cu和稀HNO3制备NO,写出反应的化学方程式_____________。
(2)选用如图所示装置完成Cu与NO的实验。(夹持装置略) 实验开始前,向装置中通入一段时间的N2。回答下列问题:
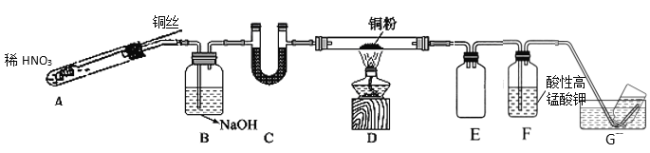
①使用铜丝的优点是_____________________装置E的作用为_______________。
②装置C中盛放的药品可能是_________;
③装置D中的现象是_______________;装置F中反应的离子方程式是_______________。
(3)测定NaNO2和NaNO3 混合溶液中NaNO2的浓度。 取25.00mL混合溶液于锥形瓶中,用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次实验数据出现异常,造成这种异常的原因可能是_________(填字母代号)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
d.酸性KMnO4溶液中含有其他氧化性试剂
e.锥形瓶洗净后用待测液润洗
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为___________________。
③NaNO2 的物质的量浓度为__________
【题目】一定温度下,向容积为2 L的密闭容器中充入一定量的气体A和气体B,发生反应: 2A(g)+B(g) ![]() 2C(g),反应过程中测定部分数据见下表(表中t1<t2),下列说法正确的是
2C(g),反应过程中测定部分数据见下表(表中t1<t2),下列说法正确的是
反应时间/min | n(A)/mol | n(B)/mol |
0 | 0.10 | 0.060 |
t1 | 0.012 | |
t2 | 0.016 |
A.在0~t1 min内的平均反应速率为v(C)=![]() molL-1min-1
molL-1min-1
B.其他条件不变,起始时向容器中充入0.10 mol C和0.010 mol B,平衡时n(A)=0.012 mol
C.保持其他条件不变,升高温度,平衡时c(A)=0.0070 molL-1,则反应的ΔH<0
D.相同温度下,起始时向容器中充入0.15mol A和0.090mol B,平衡时A转化率小于88%
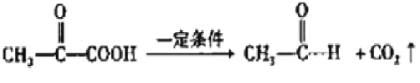
【题目】无色而有刺激性气味的甲酸,是最简单的羧酸液体,熔点8.6℃,沸点100.8℃。化学实验室常用甲酸(HCOOH)和浓硫酸混合加热制备一氧化碳,其反应方程式为:HCOOH![]() CO↑+H2O,制备时先加热浓硫酸至80℃-90℃,控制温度,再逐滴滴入甲酸。
CO↑+H2O,制备时先加热浓硫酸至80℃-90℃,控制温度,再逐滴滴入甲酸。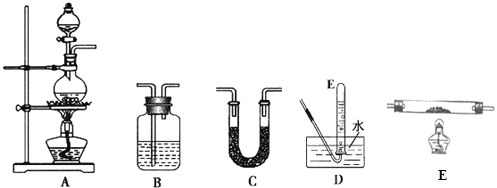
(1)请从图中选用所需的仪器(仪器可重复使用)组成一套验证甲酸(HCOOH)和浓硫酸加热生成产物的实验装置。现提供以下药品:甲酸、浓硫酸、无水硫酸铜、氧化铜粉末、澄清石灰水。将所用仪器的序号按连接顺序由上至下依次填入下表(可以不填满),并写出该仪器中应加试剂的名称或化学式(划横线部分不需要填写)。___
选用的仪器 | 加入的试剂 |
A | 甲酸、浓硫酸 |
D | -- |
证明有一氧化碳生成的现象是___。
(2)实验室可用甲酸制备甲酸铜。其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,然后再与甲酸制得四水甲酸铜[Cu(HCOO)24H2O]晶体。查阅资料可知四水甲酸铜晶体为浅蓝色晶体,可溶于水,难溶于醇。
相关的化学方程式是:2CuSO4+4NaHCO3=Cu(OH)2CuCO3↓+3CO2↑+2Na2SO4+H2O;Cu(OH)2CuCO3+4HCOOH+5H2O=2Cu(HCOO)24H2O+CO2↑
实验步骤如下:
Ⅰ.碱式碳酸铜的制备:
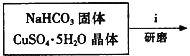
![]()
![]()
①步骤ⅰ是将一定量CuSO45H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是___。
②步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃-80℃,如果看到___(填写实验现象),说明温度过高。
Ⅱ.甲酸铜的制备:将Cu(OH)2CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质。在通风橱中蒸发滤液至原体积的![]() 时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2-3次,晾干,得到产品。
时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2-3次,晾干,得到产品。
③制取甲酸铜时需要趁热过滤的原因是___。
④用无水乙醇洗涤晶体的目的是___