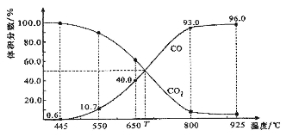
题目内容
【题目】空气吹出法工艺是目前“海水提溴”的最主要方法之一。其工艺流程如下:
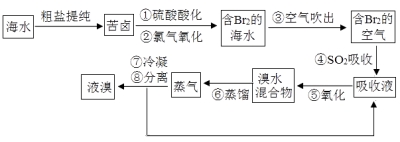
(1)步骤①中氯气氧化溴离子时在pH=3.5的酸性条件下效果最好,当使用精确pH试纸(能读数到0.1)检测步骤②氯气氧化的溶液的pH时,发现其颜色变化失常,则pH检测失败的原因是 。
(2)步骤④中反应的化学方程式为 ,该反应中体现了SO2的 性(填“氧化”或“还原”)。
(3)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,在实验室可用分液漏斗进行分离。分离时从分液漏斗的上口倒出的是 。
(4)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氧化”后再蒸馏,“空气吹出、SO2吸收、氧化”的过程实际上是一个Br2的 过程,与直接蒸馏含Br2的海水相比优点是消耗更少成本降低和
【答案】(1) 溶液中的HClO将pH试纸漂白 ;(2) SO2 + Br2 + 2H2O = H2SO4 + 2HBr,还原; (3)溴水;(4) 浓缩(或富集),效率更高。
【解析】
试题分析:(1)Cl2与水反应生成HClO,HClO具有强氧化性,将pH试纸漂白;(2)利用Br2的强氧化性,Br2+SO2+2H2O=H2SO4+2HBr,S的化合价升高,SO2被氧化,是还原剂;(3)溴水的密度小于液溴的密度,溴水在上层,使用分液漏斗时,下层液体从下口倒出,上层液体从上口倒出,因此上口倒出的液体为溴水;(4)海水中溴的含量低,需要富集,因此过程为富集,效率更高。

练习册系列答案
相关题目