题目内容
【题目】Ⅰ.现有含CaO杂质的CaC2试样。设计以下实验,测定CaC2试样的纯度。(反应方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑),请从下图中选用适当的装置,完成该实验。
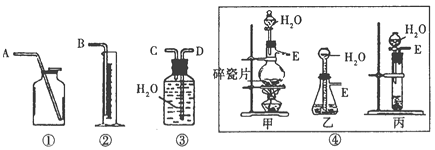
(1)制取C2H2最好选④中的_________装置(填“甲”“乙”或“丙”),所选用装置的连接顺序是_________________。(填各接口A~E的顺序)
(2)若实验时称取的试样为1.4 g,产生的乙炔在标准状况下的体积为448 mL,此试样中CaC2的质量分数为____________。(保留3位有效数字)
Ⅱ.某同学在实验室从如图标签的试剂瓶中取少许钠进行燃烧实验,实验后发现还有少许黑色固体生成。从反应物及实验操作猜测:

该黑色物质可能为炭与另一种氧化物组成的混合物。根据题意和图示回答下面问题:
(1)装置图⑤中A的名称_______________。
(2)此氧化物可能是___________或___________(写化学式)。
(3)对黑色固体物质的组成作如图⑥所示探究

①实验I加入盐酸溶液的目的是________________。
②仅通过实验Ⅱ,用最简步骤能快速确定黑色氧化物的组成,请完善该设计。(限选试剂:稀盐酸、KSCN溶液、10%H2O2溶液)

【答案】.I.(1)丙;E、C、D、B;(2)91.4%。
II.(1)坩埚;(2)FeO、Fe3O4;(3)①检验黑色固体物质中是否含有炭,同时溶解氧化物;②适量的KSCN溶液;如果溶液显红色,则黑色氧化物为Fe3O4,反之则为FeO;Fe3++3SCN-=Fe(SCN)3.
【解析】
试题分析:I.(1)碳化钙和水反应实际为碳化钙的水解反应,生成氢氧化钙和乙炔,反应为:CaC2+2H2O→Ca(OH)2+C2H2↑,是固体+液体→气体,反应不加热,但反应剧烈需要控制反应的速率,甲是固体和液体加热制气体的装置,乙装置不能控制反应进行,丙装置是固体和液体不加热制气体的装置,分液漏斗可以控制反应进行的速率,所以选丙装置;乙炔是难溶于水可以用排水量气法测定气体体积,装置的连接顺序是E、C、D、B;
(2)若实验时称取的试样为1.4g,产生的乙炔在标准状况下的体积为448mL,物质的量为0.02mol,CaC2+2H2O→Ca(OH)2+C2H2↑
64g 1mol
m 0.02mol
解得m=1.28g
所以纯度为:![]() ×100%=91.4%。
×100%=91.4%。
II.(1)根据图示仪器A的构造可知,A仪器为坩埚;
(2)实验后发现还有少许黑色固体生成,根据图1可知,金属钠中混有杂质铁,铁与氧气反应生成的黑色物质有Fe3O4和FeO,故该氧化物可能是Fe3O4或FeO.
(3)①由于黑色固体物质可能为碳和铁的氧化物,碳单质不溶于盐酸,铁的氧化物能够溶液盐酸,所以加入盐酸目的是检验黑色固体物质中是否有碳,同时溶解氧化物;②取少量实验Ⅰ澄清溶液,加入适量的KSCN溶液,如果溶液显红色,则黑色物质为Fe3O4,如果溶液没有变成红色,说明黑色物质为FeO,反应的离子方程式为Fe3++3SCN-=Fe(SCN)3。

 名校课堂系列答案
名校课堂系列答案