题目内容
【题目】碳酸钠与工农业生产、日常生活紧密相关。工业碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案。请回答下列有关问题:方案一:沉淀分析法(1)把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀_______(填操作)、洗涤、烘干、称量,洗涤沉淀的操作是____________________。方案二:气体分析法(2)把一定量的样品与足量盐酸反应后,用下图所示装置测定产生CO2的体积,为了确保测定结果的准确性,B中的溶液最好采用______________________,但选用该溶液后实验结果仍然不够准确,其原因是___________________。
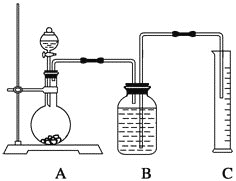
方案三:质量差分析法(3)把一定质量的样品和足量的稀硫酸反应,采用下图所示装置,通过称量反应前后盛有碱石灰的干燥管的质量,利用其质量差求算样品的纯度。

该实验的操作步骤有:①在干燥管内填满碱石灰,质量为m g;②取n g样品装入广口瓶中;③检验装置的气密性;④缓慢鼓入空气数分钟,再称量干燥管质量为w g;⑤关闭止水夹;⑥打开止水夹;⑦缓慢加入稀硫酸至不再产生气体为止;⑧缓慢鼓入空气数分钟。Ⅰ.正确的操作顺序是(填序号):③→__________→⑥→________→⑤→________→⑦→_______→④。Ⅱ.若去掉装置A,测定结果________;若去掉装置B,测定结果________(填“偏大”、“偏小”或“无影响”)。
【答案】过滤沿玻璃棒缓慢地向过滤器中加蒸馏水至浸没沉淀物,使水自然流下,重复2~3次饱和NaHCO3溶液CO2中混有的HCl与NaHCO3溶液反应生成CO2② ⑧ ① ⑥偏大偏大
【解析】(1)发生Na2CO3+CaCl2=CaCO3↓+2NaCl,测量碳酸钠的质量分数,需要测量沉淀的质量,因此操作是过滤,洗涤沉淀的方法是沿玻璃棒缓慢地向过滤器中加蒸馏水至浸没沉淀物,使水自然流下,重复2~3次;(2)本实验需要通过排水法测量CO2的体积,但CO2能溶于水,因此B中盛放饱和碳酸氢钠溶液,减少CO2的溶解,减少误差;产生的CO2中混有HCl,HCl和碳酸氢钠反应产生CO2,测量的CO2的体积增大,B和C的导管中会有小部分液体,造成CO2的体积减小;(3)I.此实验有气体参加反应,需要检验装置的气密性,即③,装入药品,即②,打开止水夹,装置中含有空气,空气中有CO2,对CO2的测定产生干扰,因此必须除去,缓慢通入空气,关闭止水夹,干燥管中装满碱石灰,并称量其质量,打开分液漏斗的活塞,缓慢滴入稀硫酸, 至到不再产生气体为止,打开止水夹,缓慢通入一段时间空气,让产生的CO2全部被吸收,再称量干燥管的质量,顺序是③→②→⑥→⑧→⑤→①→⑦→⑥→④;II.装置A的作用是吸收空气中CO2,如果去掉,则造成CO2的质量增大,即碳酸钠的质量增大,测定结果偏大;装置B作用是吸收CO2的水,如果去掉,水被碱石灰吸收,所测碳酸钠的质量增大,即结果偏高。

 快捷英语周周练系列答案
快捷英语周周练系列答案