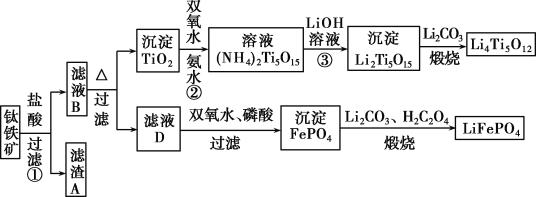
题目内容
【题目】关于下列各图像的说法中正确的是
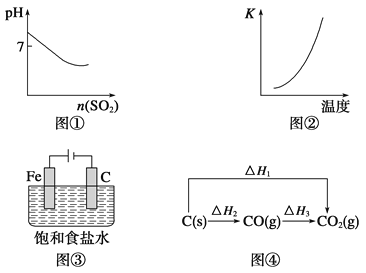
A.图①表示将SO2气体通入溴水中
B.图②表示反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0的平衡常数K随温度的变化
2NH3(g) ΔH<0的平衡常数K随温度的变化
C.图③中阴、阳两极收集到的气体体积之比一定为1∶1
D.图④中的ΔH1<ΔH2
【答案】D
【解析】
试题分析:A、溴水溶液呈酸性,反应为Br2+H20═HBr+HBr0,pH<7,与图象中的pH>7不符,故A错误;B、反应N2(g)+3H2(g)2NH3(g),△H<0,反应放热,温度升高平衡向逆反应方向移动,K减小,故B错误;C、铁做阳极,阳极上铁放电没有气体生成,阳极反应为Fe-2e-═Fe2+,阴极上有氢气生成,故C错误;D、根据盖斯定律可知△H1=△H2+△H3,由于反应都放热,则△H<0,故△H1<△H2,故D正确;故选D。

练习册系列答案
相关题目