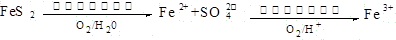题目内容
化工生产必须遵循科学原理.请根据下列工艺生产流程回答问题.
(1)某化学课外活动小组以海带为原料获得少量碘水,并以CCl4为溶剂将碘从碘水中提取出来.具体过程如下图所示:
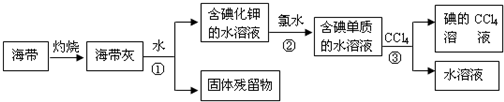
则:操作①的名称是______,在操作过程中使用到的玻璃仪器有______.操作②中发生反应的化学方程式为______.操作③为萃取,为什么不能用酒精代替CCl4作为萃取剂?______.
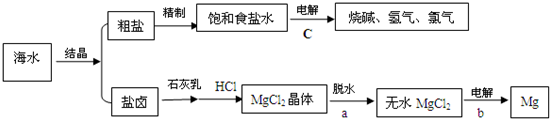
(2)海水的综合利用可以制备金属钠和镁,其流程如下图所示:
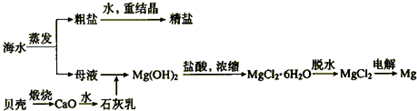
①若在空气中加热MgCl2?6H2O生成的是Mg(OH)Cl或MgO,而MgO的熔沸点非常高,达到熔融状态需要消耗很多能源.所以,用电解法制取金属镁时,需要无水氯化镁.写出用电解法制取金属镁的化学方程式______.
②Mg(OH)2沉淀和盐酸反应的离子方程式为______.
③实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明这三种情况下使用玻璃棒的目的:
溶解时:______;过滤时:______;蒸发时:______.
④工业上把电解饱和食盐水称为“氯碱工业”.电解食盐水不能得到金属钠单质.请你写出电解饱和食盐水的化学方程式______.
(1)某化学课外活动小组以海带为原料获得少量碘水,并以CCl4为溶剂将碘从碘水中提取出来.具体过程如下图所示:

则:操作①的名称是______,在操作过程中使用到的玻璃仪器有______.操作②中发生反应的化学方程式为______.操作③为萃取,为什么不能用酒精代替CCl4作为萃取剂?______.
(2)海水的综合利用可以制备金属钠和镁,其流程如下图所示:

①若在空气中加热MgCl2?6H2O生成的是Mg(OH)Cl或MgO,而MgO的熔沸点非常高,达到熔融状态需要消耗很多能源.所以,用电解法制取金属镁时,需要无水氯化镁.写出用电解法制取金属镁的化学方程式______.
②Mg(OH)2沉淀和盐酸反应的离子方程式为______.
③实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明这三种情况下使用玻璃棒的目的:
溶解时:______;过滤时:______;蒸发时:______.
④工业上把电解饱和食盐水称为“氯碱工业”.电解食盐水不能得到金属钠单质.请你写出电解饱和食盐水的化学方程式______.
(1)过滤适用于分离不溶于水的固体和液体,海带灰难溶于水,碘元素以碘离子的形式存在于溶液中,所以将海带烧成灰,向灰中加水搅拌用过滤分离它们;过滤操作中需要的仪器有玻璃棒、烧杯、漏斗、铁架台等,其中用到的三种玻璃仪器是漏斗、烧杯、玻璃棒;烧杯用来盛放液体,漏斗用于过滤,玻璃棒用来引流和搅拌;氯气能氧化碘离子得到氯离子和单质碘:2I-+Cl2═I2+2Cl-;根据萃取剂的选取标准知,酒精和水任意比互溶,所以不能作萃取剂,
故答案为:过滤;漏斗、玻璃棒、烧杯;Cl2+2I-=I2+2Cl-;酒精和水任意比互溶;
(2)①电解熔融的氯化镁得到Mg与氯气,反应方程式为:MgCl2
Mg+Cl2↑,
故答案为:MgCl2
Mg+Cl2↑;
②将沉淀物与盐酸反应生成氯化镁和水,反应的化学方程式:Mg(OH)2+2H+=Mg2++2H2O,故答案为:Mg(OH)2+2H+=Mg2++2H2O;
③粗盐提纯过程中溶解用玻璃棒搅拌加速溶解,过滤操作中玻璃棒起到引流作用,蒸发操作主要是起到搅拌作用,避免局部受热液体飞溅;
④“氯碱工业”是指饱和食盐水在直流电的条件下生成氢氧化钠、氯气和氢气,反应为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑.
故答案为:过滤;漏斗、玻璃棒、烧杯;Cl2+2I-=I2+2Cl-;酒精和水任意比互溶;
(2)①电解熔融的氯化镁得到Mg与氯气,反应方程式为:MgCl2
| ||
故答案为:MgCl2
| ||
②将沉淀物与盐酸反应生成氯化镁和水,反应的化学方程式:Mg(OH)2+2H+=Mg2++2H2O,故答案为:Mg(OH)2+2H+=Mg2++2H2O;
③粗盐提纯过程中溶解用玻璃棒搅拌加速溶解,过滤操作中玻璃棒起到引流作用,蒸发操作主要是起到搅拌作用,避免局部受热液体飞溅;
④“氯碱工业”是指饱和食盐水在直流电的条件下生成氢氧化钠、氯气和氢气,反应为:2NaCl+2H2O
| ||
故答案为:2NaCl+2H2O
| ||

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
 2NO(g),是导致汽车尾气中含有NO的原因之一。某同学为控制污染,对该反应进行研究。
2NO(g),是导致汽车尾气中含有NO的原因之一。某同学为控制污染,对该反应进行研究。