题目内容
2.(1)已知25℃时,1g H2在氧气中完全燃烧生成液态水,放出热量140kJ.写出该反应的热化学方程式:2H2(g)+O2(g)═2H2O(l)△H=-560kJ•mol-1.(2)将铁片和铜片用导线相连浸入稀硫酸中构成原电池装置:
①铁片上的电极反应式为Fe-2e-=Fe2+;
②铜片上的现象为有气泡产生;
③电流由铜片经导线流向铁片(填“铁片”或“铜片”)
分析 (1)跟据1g H2在氧气中完全燃烧生成液态水,可以计算生成2mol水放出的热量,根据热化学方程式的含义书写;
(2)①铁比铜活泼,为原电池的负极,发生氧化反应,电极方程式为Fe-2e-=Fe2+;
②铜为正极,发生还原反应,电极方程式为2H++2e-=H2↑;
③电流由正极流向负极.
解答 解:(1)1g H2在氧气中完全燃烧生成液态水,放出热量140kJ,所以4g氢气和氧气反应生成2摩尔水蒸气放热140kJ×4=560kJ的热量,即2H2(g)+O2(g)═2H2O(l)△H=-560 kJ•mol-1,
故答案为:2H2(g)+O2(g)═2H2O(l)△H=-560kJ•mol-1;
(2)①铁比铜活泼,为原电池的负极,发生氧化反应,电极方程式为Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+;
②铜为正极,发生还原反应,电极方程式为2H++2e-=H2↑,所以铜片上有气体产生,故答案为:有气泡产生;
③电流由正极流向负极,所以电流由铜片经导线流向铁片,故答案为:铜片;铁片.
点评 本题考查原电池知识,为高频考点,侧重于学生的分析能力的考查,注意把握原电池的工作原理,把握电极方程式的书写,难度不大.

练习册系列答案
相关题目
12.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA | |
| B. | 22.4L CO2与过量的Na2O2反应,转移的电子数为NA | |
| C. | 物质的量浓度为0.3mol/L的BaCl2溶液中,含有Cl- 个数为0.6NA | |
| D. | 3mol NF3(F元素为-1价)与水完全反应生成HF、HNO3和NO,转移电子数2NA |
13.Na2CO3和NaHCO3是厨房中常见物质,下列叙述不正确的是( )
| A. | Na2CO3和NaHCO3都能与食醋反应放出CO2气体 | |
| B. | Na2CO3和NaHCO3的水溶液均呈碱性 | |
| C. | Na2CO3和NaHCO3的焰色反应均呈黄色 | |
| D. | NaHCO3比Na2CO3热稳定性强 |
17.已知H2(g)+Br2(g)═2HBr(g)△H=-70KJ/mol,其它相关数据如下表:
则表中a为( )
| H2(g) | Br2(g) | HBr(g) | |
| 1mol 分子中的化学键断裂时需要吸收的能量/KJ | 410 | a | 370 |
| A. | 400 | B. | 260 | C. | 230 | D. | 200 |
7.下列有关实验说法中,正确的是( )
| A. | 使用干燥洁净玻璃棒将氯水滴在干燥pH试纸上,测定氯水的pH | |
| B. | 葡萄糖银镜反应实验后的试管内壁附C有银,可用氨水清洗 | |
| C. | 氢氧化铁胶体在直流电场中,一段时间阴极附近红褐色加深,说明胶体带正电 | |
| D. | 欲检验Brˉ的存在,可在溶液中先加入氯水、再加入CCl4,振荡、静置,观察下层溶液显橙红色 |
11.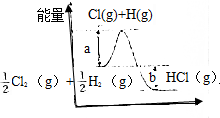 氢气在氯气中燃烧的化学方程式为$\frac{1}{2}$Cl2 (g)+$\frac{1}{2}$H2 (g)═HCl(g),该反应过程中的能量变化如图所示,下列有关叙述正确的是( )
氢气在氯气中燃烧的化学方程式为$\frac{1}{2}$Cl2 (g)+$\frac{1}{2}$H2 (g)═HCl(g),该反应过程中的能量变化如图所示,下列有关叙述正确的是( )
 氢气在氯气中燃烧的化学方程式为$\frac{1}{2}$Cl2 (g)+$\frac{1}{2}$H2 (g)═HCl(g),该反应过程中的能量变化如图所示,下列有关叙述正确的是( )
氢气在氯气中燃烧的化学方程式为$\frac{1}{2}$Cl2 (g)+$\frac{1}{2}$H2 (g)═HCl(g),该反应过程中的能量变化如图所示,下列有关叙述正确的是( )| A. | a代表反应物的总能量 | B. | a+b代表生成物的总能量 | ||
| C. | 该反应为放热反应 | D. | 反应焓变△H=bkJ•mol-1 (b>0) |
1.下列化学用语表达方式正确的是( )
| A. | 碳-12符号:612C | B. | 氯化氢电子式: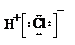 | ||
| C. | 次氯酸结构式:H-Cl-O | D. | 氯化镁电子式: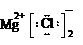 |


 ;
; ;
; .
.