题目内容
10.把19.2g 的Cu放500mL的稀硝酸中,微热至Cu完全反应.求:(1)参加反应的硝酸的物质的量;
(2)生成的NO在标准状况下的体积.
(3)向反应后的溶液中加入1mol•L-1的NaOH溶液800mL时刚好使溶液中的Cu2+完全沉淀,求原硝酸溶液的物质的量浓度.(假设反应前后溶液的体积不变)
分析 (1)(2)根据n=$\frac{m}{M}$计算19.2gCu的物质的量,根据3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O计算参加反应的硝酸的物质的量和生成的NO在标准状况下的体积;
(3)加入氢氧化钠恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中溶质为NaNO3,根据钠离子守恒有:n(NaNO3)=n(NaOH),由N原子守恒可知:n(HNO3)=n(NaNO3)+n(NO),再根据c=$\frac{n}{V}$计算.
解答 解:(1)(2)19.2gCu的物质的量=$\frac{19.2g}{64g/mol}$=0.3mol,设参加反应的硝酸的物质的量为x,生成的NO在标准状况下的体积为y,
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3mol 8mol 44.8L
0.3mol x y
$\frac{3mol}{0.3mol}=\frac{8mol}{x}$=$\frac{44.8L}{y}$;x=0.8mol,y=4.48L
答:(1)参加反应的硝酸的物质的量为0.8mol;(2)生成的NO在标准状况下的体积为4.48L;
(3)1mol•L-1的NaOH溶液800mL中溶质的物质的量为:1mol•L-1×0.8L=0.8mol,所以n(HNO3)=n(NaNO3)+n(NO)=0.8mol+$\frac{4.48L}{22.4L/mol}$=1mol,所以硝酸溶液的物质的量浓度为:$\frac{1mol}{0.5L}$=2mol/L,答:原硝酸溶液的物质的量浓度为:2mol/L.
点评 本题考查化学方程式计算,难度中等,注意利用守恒思想进行解答,第(3)小题要根据恰好完全反应后得到单一的硝酸钠,根据组成守恒分析解答.

 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案| A. | K+ Na+ HCO3- NO3- | B. | Na+ SO42- Cl- ClO- | ||
| C. | H+ Mg2+ SO42- NO3- | D. | Ag+ K+ NO3- Na+ |
| A. | 氧化铁与硝酸反应 | B. | 木炭与浓硝酸反应 | ||
| C. | 铜与硝酸反应 | D. | 氢氧化铝与硝酸反应 |
| A. | CH3Cl | B. |  | C. | CH3COOH | D. |  |
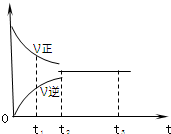 如图是可逆反应X2+3Y2?2Z2 在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应X2+3Y2?2Z2 在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t1时,正反应速率小于逆反应速率 | B. | t2时,正反应速率等于逆反应速率 | ||
| C. | t2-t3,该可逆反应不再发生 | D. | t2-t3,各物质的浓度不再发生变化 |