题目内容
12.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA | |
| B. | 22.4L CO2与过量的Na2O2反应,转移的电子数为NA | |
| C. | 物质的量浓度为0.3mol/L的BaCl2溶液中,含有Cl- 个数为0.6NA | |
| D. | 3mol NF3(F元素为-1价)与水完全反应生成HF、HNO3和NO,转移电子数2NA |
分析 A、常温下,铁在浓硝酸中会钝化;
B、二氧化碳所处的状态不明确;
C、溶液体积不明确;
D、NF3与水发生氮元素的歧化反应:3NF3+5H2O=2NO+HNO3+9HF.
解答 解:A、常温下,铁在浓硝酸中会钝化,反应程度很小,铁不能完全反应,故转移的电子数小于0.3NA,故A错误;
B、二氧化碳所处的状态不明确,故22.4L二氧化碳的物质的量不能确定,故过量的Na2O2反应,转移的电子数不一定为NA,故B错误;
C、溶液体积不明确,故含有的氯离子的个数不能计算,故C错误;
D、NF3与水发生氮元素的歧化反应,根据得失电子数守恒可知有反应:3NF3+5H2O=2NO+HNO3+9HF,在此反应中,3molNF3转移2mol电子即2NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的运用和物质的结构以及状态是解题的关键,难度不大.

练习册系列答案
相关题目
2.下列物质中,既含离子键又含共价键的是( )
| A. | KCl | B. | NaOH | C. | HCl | D. | O2 |
3.关于Na2CO3和NaHCO3性质的有关叙述正确的是( )
| A. | 在水中溶解性:Na2CO3<NaHCO3 | |
| B. | 热稳定性:Na2CO3<NaHCO3 | |
| C. | 相同条件下与酸反应的快慢Na2CO3<NaHCO3 | |
| D. | Na2CO3不能转化成NaHCO3,而NaHCO3能转化为Na2CO3 |
7.用赤铁矿为原料冶炼铁,应采取的冶炼方法是( )
| A. | 电解法 | B. | 热氧化法 | C. | 热还原法 | D. | 热分解法 |
4.下列说法中,正确的是( )
| A. | 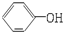 与 与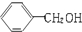 互为同系物 互为同系物 | B. | 乙醇和乙醚互为同分异构体 | ||
| C. | 乙醇、乙二醇、丙三醇互为同系物 | D. | 分子式为C4H8的烃可能为饱和烃 |
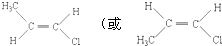 ,另一种名称是反-1-氯丙烯(顺-1-氯丙烯).
,另一种名称是反-1-氯丙烯(顺-1-氯丙烯).