题目内容
【题目】CuCl是应用广泛的有机合成催化剂,也在染料工业中用作实效型气体吸收剂。利用废旧印刷电路板制氯化亚铜可减少污染、实现资源再生。请回答下列问题:
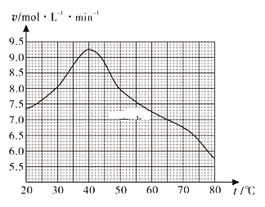
(1)废旧印刷电路板经粉碎分离能得到金属粉末,控制其他条件相同,用10%H2O2和3.0mol·L-1 H2SO4的混合溶液处理印刷电路板的金属粉末,测得不同温度下铜的平均溶解速率如图所示。在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的离子方程式为______。当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______。
(2)工业上常用CuSO4来制备CuCl。在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl,加热,生成CuCl沉淀,该反应的离子方程式是__________。
(3)在盐酸中CuCl能吸收CO,发生的反应为 CuCl+CO+H2O![]() Cu(CO)Cl·H2O H<0,要加大CO的吸收率,适宜的条件是_____________。
Cu(CO)Cl·H2O H<0,要加大CO的吸收率,适宜的条件是_____________。
(4)工业制备CuCl需要配制质量分数为20.0%的CuSO4溶液(密度为1.2g·cm-3),配制该溶液所需CuSO4·5H2O与H2O的质量之比为_______,所得溶液的物质的量浓度为______。
(5)工业检测CuCl产品的纯度需要80mL0.5mol/L的FeCl3溶液,配制该溶液所需仪器除托盘天平(含砝码、质量相同的两纸片)、烧杯外,还必需___________________。
【答案】Cu+H2O2+2H+=Cu2++2H2O 温度升高,H2O2分解速率加快 2Cu2++SO32-+2Cl-+H2O![]() 2CuCl↓+SO42-+2H+ 低温、加压 5:11 1.5mol/L 药匙、100mL容量瓶、玻璃棒、胶头滴管
2CuCl↓+SO42-+2H+ 低温、加压 5:11 1.5mol/L 药匙、100mL容量瓶、玻璃棒、胶头滴管
【解析】
(1)在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O,再进行书写离子方程式;铜溶解时需要双氧水,当温度高于40℃时,容易分解而降低溶解速率。
(2)CuSO4溶液中加入一定量的Na2SO3和NaCl,发生氧化还原反应,亚硫酸根被氧化,氯化铜被还原,生成CuCl沉淀,根据守恒来书写离子方程式。
(3)根据方程式CuCl+CO+H2O![]() Cu(CO)Cl·H2O H<0,平衡需要正向移动,才能加大CO的吸收率,再根据反应是体积减小的放热反应得出适宜的条件。
Cu(CO)Cl·H2O H<0,平衡需要正向移动,才能加大CO的吸收率,再根据反应是体积减小的放热反应得出适宜的条件。
(4)设CuSO4·5H2O的质量为xg,H2O的质量为yg,建立关系式得出比例关系,再根据浓度公式进行计算得出浓度。
(5)配制80 mL 0.5 mol/L的FeCl3溶液,最重要要使用100mL容量瓶、天平(含砝码、质量相同的两纸片)、烧杯、药匙、玻璃棒、胶头滴管等仪器。
(1)在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的离子方程式为Cu+H2O2+2H+=Cu2++2H2O。当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,溶解时需要双氧水,而双氧水在温度比较高时,容易分解而降低溶解速率,其主要原因是温度升高,H2O2分解速率加快。
(2)工业上常用CuSO4来制备CuCl。在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl,发生氧化还原反应,亚硫酸根被氧化,氯化铜被还原,生成CuCl沉淀,该反应的离子方程式是2Cu2++SO32-+2Cl-+H2O![]() 2CuCl↓+SO42-+2H+。
2CuCl↓+SO42-+2H+。
(3)在盐酸中CuCl能吸收CO,发生的反应为CuCl+CO+H2O![]() Cu(CO)Cl·H2O H<0,要加大CO的吸收率,平衡需要正向移动,适宜的条件是降低温度,加压,故答案为:低温、高压。
Cu(CO)Cl·H2O H<0,要加大CO的吸收率,平衡需要正向移动,适宜的条件是降低温度,加压,故答案为:低温、高压。
(4)工业制备CuCl需要配制质量分数为20.0%的CuSO4溶液(密度为1.2 g·cm-3),配制该溶液所需CuSO4·5H2O与H2O的质量之比,设CuSO4·5H2O的质量为xg,H2O的质量为yg,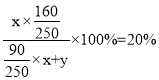 ,解得x:y=5:11,所得溶液的物质的量浓度为
,解得x:y=5:11,所得溶液的物质的量浓度为![]() 。
。
(5)工业检测CuCl产品的纯度需要80 mL 0.5 mol/L的FeCl3溶液,配制该溶液所需仪器除托盘天平(含砝码、质量相同的两纸片)、烧杯外,还必需药匙、100 mL容量瓶、玻璃棒、胶头滴管,故答案为:药匙、100 mL容量瓶、玻璃棒、胶头滴管。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案