题目内容
【题目】已知常温下水的离子积常数Kw=1.0×10-14,在100℃时水的离子积常数Kw=1.0×10-12。将常温下的下列溶液加热至100℃(忽略溶液体积变化),溶液的pH不变的是( )
A.Na2SO4溶液B.稀H2SO4溶液C.NaOH溶液D.HCl的浓溶液
【答案】B
【解析】
A、Na2SO4溶液中c(H+)=![]() mol/L,在加热过程中,Kw逐渐增大,溶液pH逐渐减小,故A不符合题意;
mol/L,在加热过程中,Kw逐渐增大,溶液pH逐渐减小,故A不符合题意;
B、稀H2SO4溶液中c(H+)≈2c(H2SO4),在加热过程中,c(H2SO4)几乎不变,故溶液pH不变,故B符合题意;
C、NaOH溶液中c(H+)=![]() mol/L,加热过程中,c(OH-)几乎不变,但Kw逐渐增大,故溶液pH逐渐减小,故C不符合题意;
mol/L,加热过程中,c(OH-)几乎不变,但Kw逐渐增大,故溶液pH逐渐减小,故C不符合题意;
D、HCl的浓溶液中c(H+)=c(HCl),在加热过程中,HCl逐渐挥发,c(H+)逐渐减小,溶液pH逐渐增大,故D不符合题意;
故答案为B。

 阅读快车系列答案
阅读快车系列答案【题目】湿法炼锌产生的铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质,生产金属镉的工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1 mol/L)
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.2 |
沉淀完全的pH | 3.3 | 9.9 | 9.5 |
(1)酸浸时粉碎铜镉渣的目的是__________。
(2)操作Ⅰ产生的滤渣主要成分为________(填化学式)。
(3)①操作Ⅲ中先加入适量H2O2,发生反应的离子方程式为______。
②再加入ZnO控制反应液的pH,pH范围为______。
③若加入的H2O2不足,加入ZnO后所得的电解液中会含有Fe元素。请设计实验方案鉴别________。
(4)净化后的溶液用惰性电极电解可获得镉单质。电解废液中可循环利用的溶质是_________。
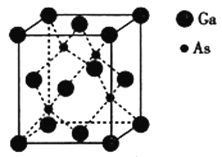
【题目】以氮化镓(GaN)、砷化镓(GaAs)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点,如砷化镓灯泡寿命是普通灯泡的100倍,而耗能即为10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。请回答下列问题:
(1)基态镓原子的价电子排布式为___。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为__和+3。砷的电负性比镓__(填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,GaCl3、GaBr3、GaI3的熔、沸点依次升高,分析其变化原因:__。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是__。
(4)①砷化镓是将(CH3)3Ga和AsH3用MOCVD(金属有机物化学气相淀积)方法制备得到的,该反应在700℃进行,反应的方程式为:___。
②反应物AsH3分子的几何构型为__,(CH3)3Ga中镓原子杂化方式为__。
(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm,As的配位数为__,晶体的密度为__(设NA为阿伏加德罗常数的数值,列出算式即可)g·cm-3。