题目内容
【题目】实验室利用如图装置探究SO2还原CuO,并进一步检测产物含量。已知Cu2O+2H+=Cu+Cu2++H2O。
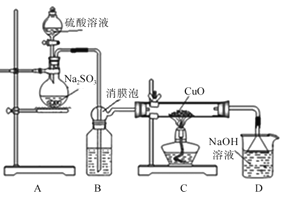
回答下列相关问题:
I.SO2还原CuO的探究
(1)装置B中宜放入的试剂为__,消膜泡的作用是__。
(2)使用98%的H2SO4溶液制备SO2的速率明显小于使用65%的H2SO4溶液制备SO2,原因是__。
(3)充分反应后,黑色固体变为红色。取C中适量的产物,加水后溶液显蓝色并有红色沉淀物,取红色沉淀物滴加盐酸,溶液又呈蓝色并仍有少量红色不溶物,由此可以得出SO2与CuO反应的方程式为__。
II.生成物中CuSO4含量检测
(4)用“碘量法”测定产物中CuSO4含量。取mg固体溶解于水配制为250mL溶液,取20.00mL溶液滴加几滴稀硫酸,再加入过量KI溶液,以淀粉为指示剂用Na2S2O3标准溶液滴定,相关化学反应为2Cu2++4I-=2CuI↓+I2,I2+I-![]() I3-,I2+2S2O32-=S4O62-+2I-。
I3-,I2+2S2O32-=S4O62-+2I-。
①Na2S2O3标准溶液易变质,滴定前需要标定。配制该溶液时需要的玻璃仪器有烧杯、___、玻璃棒和试剂瓶。
②若消耗0.1000mol/LNa2S2O3标准溶液VmL,则产物中CuSO4质量分数为__(写表达式)。
③CuI沉淀物对I3-具有强的吸附能力,由此会造成CuSO4质量分数测定值__(填“偏大”或“偏小”)。为减少实验误差.滴定过程中,常常在接近终点时加入KSCN,使CuI转化为溶解度更小的CuSCN,该沉淀物对I吸附能力极弱,KSCN加入太早,I2的浓度较大,I2会将SCN-氧化生成SO42-和ICN,该反应的离子方程式为__。
【答案】浓硫酸 防止B中液体被吹入装置C中 98%的H2SO4溶液中c(H+)较小,反应速率较小 ![]() 量筒
量筒  偏小
偏小 ![]()
【解析】
(1)结合装置B的作用回答;
(2)从影响反应速率的因素回答;
(3)结合信息Cu2O+2H+=Cu+Cu2++H2O,显示SO2与CuO反应的产物中有Cu2O,是氧化还原反应,按规律写化学方程式;
(4)①Na2S2O3标准溶液易变质,滴定前需要标定。配制该溶液时只需要粗配来回答;
②找出Na2S2O3和CuSO4的关系式计算即可;
③CuI沉淀物吸附I3-,对消耗Na2S2O3的量的影响、进一步造成CuSO4质量分数测定值的偏差来回答,I2将SCN-氧化生成SO42-和ICN,结合氧化还原反应规律找产物并书写离子方程式。
(1)制备二氧化硫气体时会含有水蒸气杂质,装置B中宜放入浓硫酸,目的是除去水蒸气杂质;
答案为:浓硫酸;
若生成二氧化硫气流速率太快,易将B中硫酸溶液带入装置C中,消膜泡能够防止硫酸溶液被吹入C装置中;
答案为:防止B中液体被吹入装置C中;
(2)制取二氧化硫的反应实质是氢离子和亚硫酸根离子反应,98%的硫酸溶液中溶质主要是硫酸分子,而氢离子浓度较小,所以反应速率较慢;
答案为:98%的硫酸溶液中c(H+)较小,反应速率较小;
(3)结合信息Cu2O+2H+=Cu+Cu2++H2O,显示SO2与CuO反应的产物中有Cu2O,SO2被CuO氧化为硫酸根,则反应为:![]() ;
;
答案为:![]() ;
;
(4)①Na2S2O3溶液配制需要标定,不需要特别精确体积的容量瓶,配制溶液时选取量筒即可;
答案为:量筒;
②根据滴定相关化学反应为2Cu2++4I-=2CuI↓+I2,I2+2S2O32-=S4O62-+2I-,可以得出关系式2Cu2+~ I2 ~2Na2S2O3,则250mL溶液中取出20mL被滴定时,其中所含CuSO4质量设为m(CuSO4) ,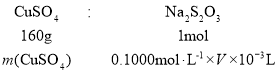 ,计算可求得m(CuSO4),则250mL中硫酸铜的质量为
,计算可求得m(CuSO4),则250mL中硫酸铜的质量为![]() ×m(CuSO4),可以得出mg生成物中硫酸铜质量分数为:
×m(CuSO4),可以得出mg生成物中硫酸铜质量分数为: ;
;
答案为: ;
;
③因为CuI沉淀物对I3离子具有强的吸附能力,会造成I2实际消耗量偏少,由此造成CuSO4质量分数测定值偏小;
答案为:偏小;
I2将SCN-氧化生成SO42-和ICN,则I2被还原为I-,并根据守恒规律,得出离子反应方程式为![]() ;
;
答案为:![]() 。
。

【题目】氮氧化物是造成雾霾天气的主要原因之一。消除氮氧化物有多种方法。
(1)可利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ·mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH=-867kJ·mol-1
则CH4(g)将NO(g)还原为N2(g)的热化学方程式是____。
(2)汽车内燃机工作时发生的反应为N2(g)+O2(g)![]() 2NO(g),生成的NO是汽车尾气的主要污染物。T℃时,向5L恒容密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量5mol(不考虑后续反应)。则5min内该反应的平均速率v(NO)=_____;在T℃时,该反应的平衡常数K=_____。
2NO(g),生成的NO是汽车尾气的主要污染物。T℃时,向5L恒容密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量5mol(不考虑后续反应)。则5min内该反应的平均速率v(NO)=_____;在T℃时,该反应的平衡常数K=_____。
(3)汽车尾气中也含有CO,已知CO能发生可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41kJ·mol-1。
CO2(g)+H2(g) ΔH=-41kJ·mol-1。
①向某容器中充入1.0molH2O(g)和1.0molCO(g),在一定条件下发生上述反应。混合气体中CO的物质的量(mol)与时间关系如下表所示:
0 | 5min | 10min | 15min | 20min | 25min | |
Ⅰ(800℃) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
Ⅱ(800℃) | 1.0 | 0.70 | 0.60 | 0.50 | 0.50 | 0.50 |
相对实验Ⅰ,实验Ⅱ改变的条件可能是_____。
②若开始时向绝热容器中投入一定量二氧化碳、氢气,在一定条件下发生上述可逆反应。下列图像正确且能说明可逆反应已达到平衡状态的是_____(填字母)。
A. B.
B. C.
C.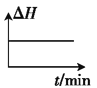 D.
D.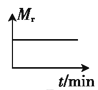
(4)利用ClO2氧化氮氧化物反应过程如下:NO![]() NO2
NO2![]() N2
N2
反应Ⅰ的产物中还有两种强酸生成,其中硝酸与NO2的物质的量相等,则其化学方程式是___。若有标准状况下11.2LN2生成,共消耗ClO2___g。
【题目】右图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的
a电极 | b电极 | x电极 | Z溶液 | |
A | 铜 | 石墨 | 负极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 银 | 铁 | 正极 | AgNO3 |
D | 铜 | 石墨 | 负极 | CuCl2 |
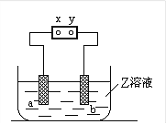
A.AB.BC.CD.D