��Ŀ����
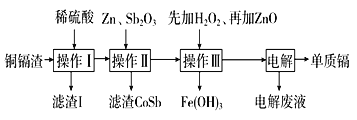
����Ŀ��ʪ����п������ͭ������Ҫ��п��ͭ��������(Cd)����(Co)�ȵ��ʣ����������ӵĹ����������£�
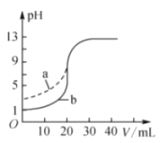
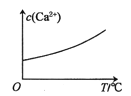
�±��г�����ؽ������������������������pH(�������ӵ���ʼŨ��Ϊ0.1 mol/L)
�������� | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 |
��ʼ������pH | 1.5 | 6.5 | 7.2 |
������ȫ��pH | 3.3 | 9.9 | 9.5 |
(1)���ʱ����ͭ������Ŀ����__________��
(2)�����������������Ҫ�ɷ�Ϊ________(�ѧʽ)��
(3)�ٲ��������ȼ�������H2O2��������Ӧ�����ӷ���ʽΪ______��
���ټ���ZnO���Ʒ�ӦҺ��pH��pH��ΧΪ______��
���������H2O2���㣬����ZnO�����õĵ��Һ�лẬ��FeԪ�ء������ʵ�鷽������________��
(4)���������Һ�ö��Ե缫���ɻ���ӵ��ʡ�����Һ�п�ѭ�����õ�������_________��
���𰸡���������ĽӴ�������ӿ췴Ӧ���ʣ����ԭ�ϵĽ����� Cu 2Fe2����H2O2��2H��=2Fe3����2H2O 3.3��pH<7.2 ȡ�����Һ�������Թ��У������еμ�K3[Fe(CN)6]��Һ��������ɫ����(�������еμ�H2O2���ٵ���KSCN��Һ������Һ���)��������Һ�к���FeԪ�� H2SO4
��������
��ʪ����п������ͭ�������������ӵ����̣�ͭ������Ҫ��п��ͭ��������(Cd)����(Co)�ȵ��ʣ�����ϡ���ᣬͭ���ܣ����ˣ���Һ����Zn2+��Fe2+��Cd2+��Zn2+��Co2+������Һ����п�����Sb2O3��п�ۻ���Sb2O3���γ���ز����Ͻ�CoSb��ȥ�ܣ�����ܺ����Һ�м���H2O2��Һ����Fe2+ΪFe3+����������п����pHʹFe3+�������˳�ȥ����⺬��Zn2+��Co2+����Һ���ɵ��ӵ��ʣ�
��1�����ʱ����ͭ����������������ĽӴ������ʹ��Ӧ��֣�
��2��ͭ������ֻ��ͭ��ϡ�����Ӧ��
��3����˫��ˮ���������ԣ��ܰ�������������Ϊ�����ӣ���ϵ����غ㡢����غ㼰ԭ���غ㼴��д��������Ӧ�����ӷ���ʽ��
�ڸ��ݱ����е���Ϣ��������ȷ��Fe3+������ȫ����Cd2+�������ʱ��pH��Χ��
�ۼ���˫��ˮ��Ŀ����������Һ���������ӣ�������Fe2+�Ļ�ԭ�Ի�Fe2+��K3[Fe(CN)6]��Һ��������ɫ�����������Ƿ�����Fe2+���ڣ�
��4��������������������ת����ϵ������ѭ�������ʡ�
��1�����ʱ����ͭ������Ŀ������������ĽӴ�������ӿ췴Ӧ���ʣ����ԭ�ϵĽ����ʣ�
�ʴ�Ϊ����������ĽӴ�������ӿ췴Ӧ���ʣ����ԭ�ϵĽ����ʣ�
��2��ͭ��ϡ�����Ӧ���������������������Ҫ�ɷ�ΪCu��
�ʴ�Ϊ��Cu��
��3����˫��ˮ���������ԣ��ܰ�������������Ϊ�����ӣ�������Ӧ�����ӷ���ʽΪ2Fe2����H2O2��2H��=2Fe3����2H2O��
�ʴ�Ϊ��2Fe2����H2O2��2H��=2Fe3����2H2O��
�ڸ��ݱ����е���Ϣ��֪��3.3��pH<7.2ʱ����ȷ��Fe3+������ȫ����Cd2+������������pH��ΧΪ3.3��pH<7.2��
�ʴ�Ϊ��3.3��pH<7.2��
���������˫��ˮ���㣬��������Һ�����������Ӳ��࣬�����������Ӽ��ɣ�����Ϊ��ȡ�����Һ�������Թ��У������еμ�K3[Fe(CN)6]��Һ��������ɫ����(�������еμ�H2O2���ٵ���KSCN��Һ������Һ���)��������Һ�к���FeԪ�أ�
�ʴ�Ϊ��ȡ�����Һ�������Թ��У������еμ�K3[Fe(CN)6]��Һ��������ɫ����(�������еμ�H2O2���ٵ���KSCN��Һ������Һ���)��������Һ�к���FeԪ�أ�
��4������Һ����Ҫ����ZnSO4��H2SO4����˿�ѭ�����õ�����ΪH2SO4��
�ʴ�Ϊ��H2SO4��

����Ŀ���������������������������Ҫԭ��֮һ���������������ж��ַ�����
��1�������ü������ԭ���������֪��
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ��H=-574kJ��mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ��H=-867kJ��mol-1
��CH4(g)��NO(g)��ԭΪN2(g)���Ȼ�ѧ����ʽ��____��
��2��������ȼ������ʱ�����ķ�ӦΪN2(g)+O2(g)![]() 2NO(g)�����ɵ�NO������β������Ҫ��Ⱦ�T��ʱ����5L�����ܱ������г���6.5molN2��7.5molO2����5minʱ��Ӧ�ﵽƽ��״̬����ʱ������NO�����ʵ���5mol(�����Ǻ�����Ӧ)����5min�ڸ÷�Ӧ��ƽ������v(NO)=_____����T��ʱ���÷�Ӧ��ƽ�ⳣ��K=_____��
2NO(g)�����ɵ�NO������β������Ҫ��Ⱦ�T��ʱ����5L�����ܱ������г���6.5molN2��7.5molO2����5minʱ��Ӧ�ﵽƽ��״̬����ʱ������NO�����ʵ���5mol(�����Ǻ�����Ӧ)����5min�ڸ÷�Ӧ��ƽ������v(NO)=_____����T��ʱ���÷�Ӧ��ƽ�ⳣ��K=_____��
��3������β����Ҳ����CO����֪CO�ܷ������淴Ӧ��CO(g)+H2O(g)![]() CO2(g)+H2(g) ��H=-41kJ��mol-1��
CO2(g)+H2(g) ��H=-41kJ��mol-1��
����ij�����г���1.0molH2O(g)��1.0molCO(g)����һ�������·���������Ӧ�����������CO�����ʵ���(mol)��ʱ���ϵ���±���ʾ��
0 | 5min | 10min | 15min | 20min | 25min | |
��(800��) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
��(800��) | 1.0 | 0.70 | 0.60 | 0.50 | 0.50 | 0.50 |
���ʵ���ʵ���ı������������_____��
������ʼʱ�����������Ͷ��һ����������̼����������һ�������·����������淴Ӧ������ͼ����ȷ����˵�����淴Ӧ�Ѵﵽƽ��״̬����_____(����ĸ)��
A.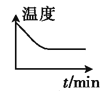 B.
B. C.
C.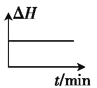 D.
D.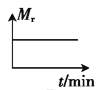
��4������ClO2�����������ﷴӦ�������£�NO![]() NO2
NO2![]() N2
N2
��Ӧ��IJ����л�������ǿ�����ɣ�����������NO2�����ʵ�����ȣ����仯ѧ����ʽ��___�����б�״����11.2LN2���ɣ�������ClO2___g��