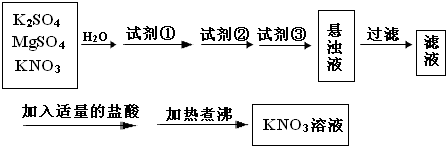
题目内容
10.铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.(1)二氧化铈(CeO2)在平板电视显示屏中有着重要应用.CeO2 在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作氧化剂.
(2)自然界Cr主要以+3价和+6价存在.+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬.完成并配平下列离子方程式:
1Cr${\;}_{7}^{2-}$+3SO${\;}_{3}^{2-}$+8H+═2Cr3++3SO${\;}_{4}^{2-}$+4H2O
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是4Na+TiCl4$\frac{\underline{\;550℃\;}}{\;}$Ti+4NaCl.
(4)NiSO4•xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得.操作步骤如下:
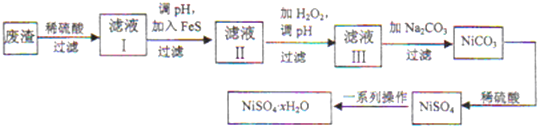
①向滤液Ⅰ中加入FeS是为了除去Cu2+ Zn2+等杂质,除去Cu2+的离子方程式为FeS+Cu2+=CuS+Fe2+.
②对滤液Ⅱ先加H2O2再调pH,调pH的目的是除去Fe3+.
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是增大NiSO4的浓度,有利于蒸发结晶(或富集NiSO4).
④为测定 NiSO4•xH2O 晶体中x的值,称取26.3g晶体加热至完全失去结晶水,剩余固体15.5g,则x的值等于6.
分析 (1)氧化还原反应中所含元素化合价降低反应物为氧化剂,二氧化铈中Ce化合价为+4价,CeO2 在稀硫酸和H2O2的作用下可生成Ce3+,化合价降低,据此判断;
(2)自然界中Cr主要以+3价和+6价存在.+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬,根据得失电子相等,Cr2O72-与SO32-的物质的量之比是1:3;依据氧化还原反应中得失电子守恒规律、原子个数守恒规律书写方程式;
(3)钠性质活泼,与熔融的四氯化钛反应生成钛和氯化钠;
(4)①硫化铜溶解度小于硫化亚铁,向含铜离子的溶液中加入FeS,能够实现沉淀的转化;
②对滤液Ⅱ加H2O2的目的是将Fe2+氧化Fe3+,然后调pH沉淀Fe3+;
③NiSO4与Na2CO3反应生成NiCO3沉淀,而后过滤,再加适量稀硫酸溶解又生成NiSO4,这样可提高NiSO4的浓度,有利于蒸发结晶;
④26.3g晶体加热至完全失去结晶水,剩余固体15.5g,失去水的质量=26.3g-15.5g=10.8g,NiSO4的质量为15.5g,计算物质的量得到1:x=$\frac{15.5g}{155g/mol}$:$\frac{10.8g}{18g/mol}$,据此计算x值.
解答 解:(1)二氧化铈中Ce化合价为+4价,CeO2 在稀硫酸和H2O2的作用下可生成Ce3+,化合价降低,氧化还原反应中所含元素化合价降低反应物为氧化剂,所以CeO2在该反应中做氧化剂;
故答案为:氧化;
(2)自然界中Cr主要以+3价和+6价存在.+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬,根据得失电子相等,Cr2O72-与SO32-的物质的量之比是1:3;反应的离子方程式:Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O,
故答案为:1,3,8H+,2,3,4;
(3)钠性质活泼,与熔融的四氯化钛反应生成钛和氯化钠,方程式:4Na+TiCl4$\frac{\underline{\;550℃\;}}{\;}$Ti+4NaCl;
故答案为:4Na+TiCl4$\frac{\underline{\;550℃\;}}{\;}$Ti+4NaCl;
(4)①硫化铜溶解度小于硫化亚铁,向含铜离子的溶液中加入FeS,能够实现沉淀的转化,离子方程式:FeS+Cu2+=CuS+Fe2+,
故答案为:FeS+Cu2+=CuS+Fe2+;
②对滤液Ⅱ加H2O2的目的是将Fe2+氧化Fe3+,然后调pH使Fe3+完全沉淀,
故答案为:除去Fe3+;
③NiSO4与Na2CO3反应生成NiCO3沉淀,然后过滤,再加适量稀硫酸溶解又生成NiSO4,这样可提高NiSO4的浓度,有利于蒸发结晶,
故答案为:增大NiSO4的浓度,利于蒸发结晶(或富集NiSO4);
④26.3g晶体加热至完全失去结晶水,剩余固体15.5g,失去水的质量=26.3g-15.5g=10.8g,NiSO4的质量为15.5g,计算物质的量得到1:x=$\frac{15.5g}{155g/mol}$:$\frac{10.8g}{18g/mol}$,解得x=6;
故答案为:6.
点评 本题为综合题,考查了氧化还原反应基本概念、方程式配平,金属的制备,物质的分离与提纯,侧重于学生的分析能力和实验能力、计算能力的考查,为高频考点和常见题型,题目难度中等,注意对基础知识的掌握.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 达到平衡时CO2的体积分数为20% | |
| B. | 降低温度,正反应速率减小程度比逆反应速率减小程度大 | |
| C. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 | |
| D. | 在达平衡的过程中,任意时刻CO和H2O的转化率都相同 |
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 |
| NH3的浓度(mol.L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | a1 | a2 | a3 |
| A. | 2c1>c3 | B. | a1+a3<1 | C. | 2p2<p3 | D. | a=b |
| A. | SO2、SiO2、CO均为酸性氧化物 | B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | ||
| C. | 烧碱、冰醋酸、四氯化碳均为电解质 | D. | 福尔马林、水玻璃、氨水均为混合物 |
| A. | NO2 | B. | CuCl2 | C. | FeCl2 | D. | SO3 |
| A. | NH4HSO3溶液与足量NaOH溶液共热:NH4++HSO3-+2OH- $\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+SO32-+2H2O | |
| B. | 向氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 大理石溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液Fe2++2H++H2O2═Fe3++2H2O |