题目内容
【题目】A、B、C、D、E为原子序数依次增大的5种短周期主族元素,其中仅含有一种金属元素,A单质是自然界中密度最小的气体,A和D最外层电子数相同;B元素原子结构示意图为![]() ;C和E在周期表中相邻,且E的质子数是C的2倍。请回答下列问题:
;C和E在周期表中相邻,且E的质子数是C的2倍。请回答下列问题:
(1)B位于第____________周期_____________族;
(2)E的离子结构示意图是_________________;DA中含有______________。(填化学键类型)
(3)用电子式表示BC2的形成过程________________________________________;(用具体元素表示)
(4)C、D、E三种元素简单离子的离子半径由大到小的顺序是______________________。(用具体离子符号表示)
【答案】二 IVA 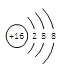 离子键
离子键 ![]() S2->O2->Na+
S2->O2->Na+
【解析】
A、B、C、D、E为原子序数依次增大的五种短周期主族元素,A单质试自然界中密度最小的气体,是A为H元素;B元素原子结构示意图为![]() ;则B为C元素,A和D最外层电子数相同,则二者处于同族,且D在C元素的后面,则D处于第三周期,D为Na元素;C和E在周期表中相邻,且E的质子数是C的2倍,则C为O元素,E为S元素,据此答题。
;则B为C元素,A和D最外层电子数相同,则二者处于同族,且D在C元素的后面,则D处于第三周期,D为Na元素;C和E在周期表中相邻,且E的质子数是C的2倍,则C为O元素,E为S元素,据此答题。
由以上分析可知,A、B、C、D、E分别为:H、C、O、Na、S。
(1)B为C元素,C是6号元素,位于元素周期表的第二周期第IVA族,故答案为:二,IVA。
(2)E为S元素,S为16号元素,硫离子的核内有16个质子,核外有18个电子,离子结构示意图是 ,A为H元素,D为Na元素,NaH由活泼的金属与活泼的非金属组成,形成离子键,故答案为:
,A为H元素,D为Na元素,NaH由活泼的金属与活泼的非金属组成,形成离子键,故答案为: ,离子键。
,离子键。
(3)BC2为CO2,CO2是由两种不同的非金属形成的共价键,C的最外层有4个电子,所以形成4对共用电子对,用电子式表示CO2的形成过程为:![]() ,故答案为:
,故答案为:![]() 。
。
(4)C、D、E三种元素形成的简单离子分别为:O2-、Na+、S2-,电子层数越多,微粒的半径越大,电子层数相同时,结构相似的微粒中核电荷数大的微粒半径小,所以O2-、Na+、S2-的离子半径由大到小的顺序是S2->O2->Na+,故答案为:S2->O2->Na+。