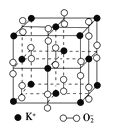
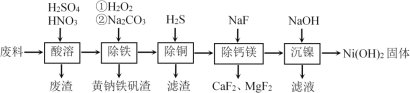
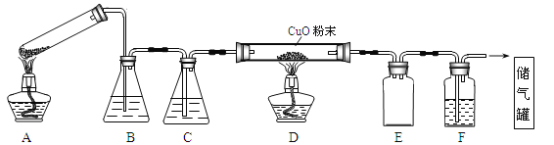
��Ŀ����
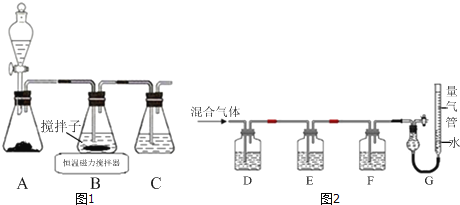
����Ŀ��ʵ���Һϳ��屽��װ��ͼ���й��������£������кϳɲ���ش�
�� | �� | �屽 | |
�ܶ�/g��cm��3 | 0.88 | 3.10 | 1.50 |
�е�/�� | 80 | 59 | 156 |
ˮ���ܽ�� | �� | �� | �� |

(1)ʵ��װ���У�����c������Ϊ__________________������Ϊ__________��
(2)��a�м���15 mL��ˮ����������м����b��С�ļ���4.0 mLҺ̬�壬��a�е��뼸���壬�а�������������Ϊ������________���壬�����μ���Һ����ꡣд��a�з�����Ӧ�Ļ�ѧ����ʽ��__________________��
(3)Һ�����������в�������ᴿ��
����a�м���10 mLˮ��Ȼ����˳�ȥδ��Ӧ����м��
����Һ������10 mLˮ��8 mL 10%��NaOH��Һ��10 mLˮϴ�ӡ�NaOH��Һϴ�ӵ�����__________��
����ֳ��Ĵ��屽�м�����������ˮ�Ȼ���(һ�ָ����)�����á����ˡ�������ˮ�Ȼ��Ƶ�Ŀ����__________________��
(4)�����Ϸ���������屽�л����е���Ҫ����Ϊ______��Ҫ��һ���ᴿ������еIJ�������Ϊ________��
���𰸡����������� �������� HBr 2Fe+3Br2=2FeBr3��![]() +Br2
+Br2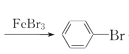 +HBr ��ȥδ��Ӧ��Br2 �����屽 �� ����
+HBr ��ȥδ��Ӧ��Br2 �����屽 �� ����
��������
���������ñ���Һ�������廯���������������£���������ƿ�ڷ���ȡ����Ӧ�Ʊ��屽����Ӧ������Ϊ��ֹҺ��ͱ��Ļӷ������ԭ�������ʣ��������ܽ�������������ͬʱ�������ɵ�HBr���壬�Է�ֹ������Ⱦ����Ӧ��Ļ����ͨ�����˳�ȥ��������ۣ�Ȼ��������������Һϴȥû�з�Ӧ���弰���ɵ�HBr������ˮ�Ȼ��Ƹ�����ٽ�����������ᴿ��
(1)���������ṹ��֪������c�����������ܣ�ʹ��װ�õ�Ŀ����ʹ�ӷ�����ͱ������������»ص���Ӧ�����ڣ����ԭ�������ʣ�
(2)����Һ�巢��ȡ����Ӧ�����屽��HBr����Ӧ����HBr������ˮ�����γɰ�����װ��a�з�����Ӧ�Ļ�ѧ����ʽΪ2Fe+3Br2=2FeBr3��![]() +Br2
+Br2 +HBr��
+HBr��
(3)�屽�ᴿ�ķ����ǣ�����ˮϴ���ѿ������ܽ���ˮ�У�Ȼ����˳�ȥδ��Ӧ����м���ڼ�NaOH��Һ��������Ӧ��2NaOH+Br2=NaBr+NaBrO+H2O��ʹδ��Ӧ��Br2���NaBr��NaBrO���뵽ˮ�У�
�ۼ���ˮ�Ȼ������������������ˮ�Ȼ��Ƶ������Ǹ����屽��
(4)�����������õ����屽����������δ��Ӧ�ı��������屽���ܣ������ߵķе㲻ͬ�������˵���ķе�ϵͣ����Բ�������ķ������з��롣

 ���ѵ����Ԫ��ĩ���100��ϵ�д�
���ѵ����Ԫ��ĩ���100��ϵ�д� ��˼άС�ھ�100����ҵ��ϵ�д�
��˼άС�ھ�100����ҵ��ϵ�д� ��ʦָ��һ��ͨϵ�д�
��ʦָ��һ��ͨϵ�д�