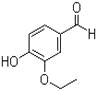
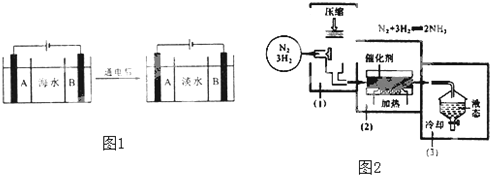
题目内容
【题目】浙江大学成功研制出能在数分钟之内将电量充满的Li-SOCl2电池,该电池是迄今具有最高能量比的电池其成本只有传统锂电池的一半。若电解液为LiAlCl4﹣SOCl2,电池的总反应为:4Li+2SOCl2![]() 4LiCl+S+SO2。下列说法不正确的是( )
4LiCl+S+SO2。下列说法不正确的是( )
A.放电时,负极反应式为:Li – e- = Li+
B.若用该电池作为外接电源电镀铜,当阴极质量增加64 g时,理论上将消耗14g Li
C.放电时,电解液中Li+向负极迁移
D.充电时,阳极反应式为:4Cl﹣+S+SO2﹣4e﹣=2SOCl2
【答案】C
【解析】
A. 从价态变化看,Li为负极,放电时,负极反应式为:Li – e- = Li+,A正确;
B.当阴极质量增加64 g时,电路中转移电子为2mol,理论上将消耗2molLi,质量为2mol×7g/mol=14g Li,B正确;
C. 放电时,电解液中Li+向正极迁移,C不正确;
D. 充电时,阳极S失电子,发生反应4Cl﹣+S+SO2﹣4e﹣=2SOCl2,D正确。
故选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
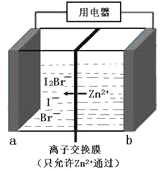
小学生10分钟应用题系列答案【题目】实验室合成溴苯的装置图及有关数据如下,按下列合成步骤回答:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |

(1)实验装置中,仪器c的名称为__________________,作用为__________。
(2)在a中加入15 mL无水苯和少量铁屑,在b中小心加入4.0 mL液态溴,向a中滴入几滴溴,有白雾产生,是因为生成了________气体,继续滴加至液溴滴完。写出a中发生反应的化学方程式:__________________。
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用__________;
③向分出的粗溴苯中加入少量的无水氯化钙(一种干燥剂),静置、过滤。加入无水氯化钙的目的是__________________。
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,需进行的操作方法为________。