题目内容
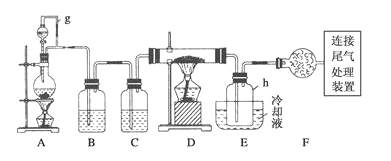
【题目】通常用碳在高温下还原二氧化硅制得粗硅,粗硅(合铁、铝、硼、磷等杂质)与氯气反应生成四氯化硅(反应温度450-500℃),四氧化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。(D的硬质玻璃管中盛装粗硅)
相关信息如下:a.四氧化硅遇水极易反应生成硅酸和氯化氢;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | 12.8 | — | 315 | — |
熔点/℃ | -70.0 | -107.2 | — | — | — |
升华温度/℃ | — | — | 180 | 300 | 162 |
请回答下列问题:
(1)写出用碳在高温下还原二氧化硅制得粗硅的化学方程式_________________________。
(2)写出装置A中发生反应的离子方程式__________________________________。
(3)装置A中g管的作用是_________________;装置C中的试剂是____________;
(4)装置E中h瓶收集到的粗产物可通过多次蒸馏得到高纯度四氯化硅,蒸馏后的残留物中,除铁元素外可能还含有的杂质元素是________(填写元素符号)。
(5)写出尾气处理装置中发生反应的离子方程式___________________________。
(6)本题实验装置中有一明显的不足之处,请简述你的改进方案及理由: ___________。
【答案】 2C+SiO2![]() Si+2CO MnO2+4H+ +2Cl-
Si+2CO MnO2+4H+ +2Cl-![]() Mn2++Cl2↑+2H2O 平衡压强,保证分液漏斗中的溶液顺利流下 浓硫酸 Al、P Cl2+2OH-=Cl-+ClO-+H2O 装置D和装置E中间的连接管较细,应改为粗管,防止气体冷凝形成液态或固态物质堵塞导管而发生危险
Mn2++Cl2↑+2H2O 平衡压强,保证分液漏斗中的溶液顺利流下 浓硫酸 Al、P Cl2+2OH-=Cl-+ClO-+H2O 装置D和装置E中间的连接管较细,应改为粗管,防止气体冷凝形成液态或固态物质堵塞导管而发生危险
【解析】(1)碳在高温下还原二氧化硅制得粗硅的化学方程式为2C+SiO2![]() Si+2CO。(2)装置A制备氯气,其中发生反应的离子方程式为MnO2+4H++2Cl-
Si+2CO。(2)装置A制备氯气,其中发生反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。(3)浓盐酸有挥发性,故分液漏斗要加盖,加盖后如没有g管,则盐酸就不易流下去,g管的作用是平衡压强,使液体顺利流出并防止漏气;生成的氯气反应前需要干燥,则装置C中的试剂是浓硫酸;(4)D中氯气与粗硅反应生成SiCl4,h瓶收集粗产物,精馏粗产品可得高纯度四氯化硅,由表中数据可以看出,蒸出SiCl4气体时,BCl3早已成气体被蒸出,而AlCl3、FeCl3、PCl5升华温度均高于SiCl4的沸点,所以当SiCl4蒸出后,而AlCl3、FeCl3、PCl5还为固体留在瓶里,除铁元素外可能还含有的杂质元素是Al、P;(5)氯气一般用氢氧化钠溶液处理,尾气处理装置中发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。(6)四氯化硅在常温下易液化,如果收集产品的导管太细易堵塞导管,所以不足是装置D和装置E中间的连接管较细,应改为粗管,防止气体冷凝形成液态或固态物质堵塞导管而发生危险。
Mn2++Cl2↑+2H2O。(3)浓盐酸有挥发性,故分液漏斗要加盖,加盖后如没有g管,则盐酸就不易流下去,g管的作用是平衡压强,使液体顺利流出并防止漏气;生成的氯气反应前需要干燥,则装置C中的试剂是浓硫酸;(4)D中氯气与粗硅反应生成SiCl4,h瓶收集粗产物,精馏粗产品可得高纯度四氯化硅,由表中数据可以看出,蒸出SiCl4气体时,BCl3早已成气体被蒸出,而AlCl3、FeCl3、PCl5升华温度均高于SiCl4的沸点,所以当SiCl4蒸出后,而AlCl3、FeCl3、PCl5还为固体留在瓶里,除铁元素外可能还含有的杂质元素是Al、P;(5)氯气一般用氢氧化钠溶液处理,尾气处理装置中发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。(6)四氯化硅在常温下易液化,如果收集产品的导管太细易堵塞导管,所以不足是装置D和装置E中间的连接管较细,应改为粗管,防止气体冷凝形成液态或固态物质堵塞导管而发生危险。
本题为传统的综合实验方案设计题,综合了氯气的制法、硅的提纯等了实验知识。掌握基础、相关物质的性质以及实验原理是解答的关键,注意掌握实验方案的设计要点及评价角度。实验方案的设计要明确以下要点:实验过程中的安全性操作、注意仪器的规格、要防倒吸、防爆炸、防燃烧、防暴沸、防氧化、防吸水、冷凝、冷却、水浴加热时采取相应措施等。