题目内容
【题目】化合物A 是一种重要的光化学试剂,属不含结晶水的盐.A~I 之间相互转化关系如下图所示: (部分反应物、生成物没有列出)

已知: A 中含两种阳离子和一种带二个单位负电荷的阴离子,三种离子的个数比为3:1:3。阴离子中各元素的质量分数与C相同且相对分子质量是C 的2倍。C、D 都为气体且含有元素种类相同,C 能使澄清石灰水变浑浊,E 是一种红棕色的颜料,F 的焰色反应呈紫色,I能使KSCN 溶液显红色。回答下列问题:
(1)A 的化学式________。
(2)①方程式________。
(3)D+E→C+G 的方程式________。
(4) H+H2O2+ H+→I 的离子反应方程式________。
(5)在A 的溶液中滴入酸性高锰酸钾溶液,高锰酸钾溶液紫色褪去;而在A 的溶液中滴入硫氰化钾溶液,溶液呈红色。产生上述现象的主要原因是________。
【答案】 K3Fe(C2O4)3 2 K3Fe(C2O4)3=Fe2O3+6CO↑+3CO2↑+3K2CO3 3CO+Fe2O3![]() 2Fe+3CO2 2Fe2++H2O2+2H+=2Fe3++2H2O 因为溶液中的草酸根被高锰酸钾氧化,故紫色褪去;滴加KSCN溶液,Fe3+与SCN-结合形成红色溶液
2Fe+3CO2 2Fe2++H2O2+2H+=2Fe3++2H2O 因为溶液中的草酸根被高锰酸钾氧化,故紫色褪去;滴加KSCN溶液,Fe3+与SCN-结合形成红色溶液
【解析】C能使澄清石灰水变浑,应为CO2,C、D都为气体且含有元素种类相同,则D为CO,E是一种红棕色的颜料,应为Fe2O3,F的焰色反应呈紫色,应含有K元素,为KCl,I为FeCl3,由转化关系可知H为FeCl2,则G为Fe, A 中阴离子中各元素的质量分数与C相同且式量是C的2倍,应为C2O42-,A中含二种阳离子和一种带二个单位负电荷的阴离子,三种离子的个数比为3:1:3,则A为K3Fe(C2O4)3,结合转化关系可知B为K2CO3。
(1)A 的化学式为:K3Fe(C2O4)3; (2)①反应是K3Fe(C2O4)3在加热条件下分解生成Fe2O3、CO、CO2、K2CO3,反应的化学方程式为:2 K3Fe(C2O4)3=Fe2O3+6CO↑+3CO2↑+3K2CO3;(3)D+E→C+G的方程式为:3CO+Fe2O3![]() 2Fe+3CO2;(4)H+H2O2+ H+→I 的离子反应方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;(5)A的溶液中中含有草酸根离子,可被酸性高锰酸钾氧化,且A中含有铁离子,可与KSCN发生显色反应,故答案为:因为溶液中的草酸根被高锰酸钾氧化,故紫色褪去;滴加KSCN溶液,Fe3+与SCN-结合形成红色溶液。
2Fe+3CO2;(4)H+H2O2+ H+→I 的离子反应方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;(5)A的溶液中中含有草酸根离子,可被酸性高锰酸钾氧化,且A中含有铁离子,可与KSCN发生显色反应,故答案为:因为溶液中的草酸根被高锰酸钾氧化,故紫色褪去;滴加KSCN溶液,Fe3+与SCN-结合形成红色溶液。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】通常用碳在高温下还原二氧化硅制得粗硅,粗硅(合铁、铝、硼、磷等杂质)与氯气反应生成四氯化硅(反应温度450-500℃),四氧化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。(D的硬质玻璃管中盛装粗硅)
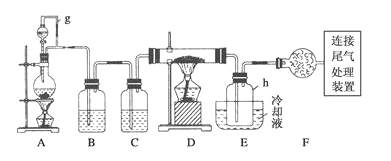
相关信息如下:a.四氧化硅遇水极易反应生成硅酸和氯化氢;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | 12.8 | — | 315 | — |
熔点/℃ | -70.0 | -107.2 | — | — | — |
升华温度/℃ | — | — | 180 | 300 | 162 |
请回答下列问题:
(1)写出用碳在高温下还原二氧化硅制得粗硅的化学方程式_________________________。
(2)写出装置A中发生反应的离子方程式__________________________________。
(3)装置A中g管的作用是_________________;装置C中的试剂是____________;
(4)装置E中h瓶收集到的粗产物可通过多次蒸馏得到高纯度四氯化硅,蒸馏后的残留物中,除铁元素外可能还含有的杂质元素是________(填写元素符号)。
(5)写出尾气处理装置中发生反应的离子方程式___________________________。
(6)本题实验装置中有一明显的不足之处,请简述你的改进方案及理由: ___________。