��Ŀ����
����Ŀ���о���Ա������ú��������Ȼ�ѧѭ��ʵ��̫���ܵ�ת����洢���������£�
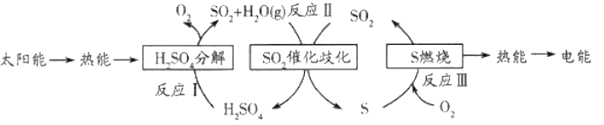
��ش��������⣺
��1����ҵ����H2SO4ʱ���һ����Ӧ�Ļ�ѧ����ʽ��_______________________��
��2����Ӧ��Ļ�ѧ����ʽ��_________________���������������뻹ԭ��������ʵ���֮����________________________��
��3����Ӧ��Ϊ�绯��Ӧ��������Ԫ�صĻ��ϼ�����____________��________________��
��4����Ӧ��������������ȼ��������________________________________���������ɵĶ�������ķ�����_________________________________________________���۲쵽��������_______________________________��
��5��������������__________����ʽ������ת�����˹����п������һ�ֻ���������_____________________________��
���𰸡�SO3+H2O��H2SO4 2H2SO4![]() 2SO2��+O2��+2H2O 1:2 +4 0��+6 ��������������ɫ���棬���ȣ������д̼�����ζ������ ������ͨ��Ʒ����Һ�У���һ����ټ��� Ʒ����Һ��ɫ���Ҽ��Ⱥ��ָֻ�ԭɫ 4 ����
2SO2��+O2��+2H2O 1:2 +4 0��+6 ��������������ɫ���棬���ȣ������д̼�����ζ������ ������ͨ��Ʒ����Һ�У���һ����ټ��� Ʒ����Һ��ɫ���Ҽ��Ⱥ��ָֻ�ԭɫ 4 ����
��������
��1����ҵ����H2SO4ʱ���һ����Ӧ�����������ˮ��Ӧ�������ᣬ�ݴ���д��
��2����Ӧ��������ֽ��������������������ˮ���ݴ���д������Ԫ�صĻ��ϼ۱仯���㣻
��3�����ݷ�Ӧ�������������Ԫ�صĻ��ϼ۷����жϣ�
��4��������ȼ�յ�ʵ��������������ö��������Ư���Լ��飻
��5������ת����ϵͼ�жϡ�
��1����ҵ����H2SO4ʱ���һ����Ӧ�����������ˮ��Ӧ�������ᣬ��Ӧ�Ļ�ѧ����ʽ��SO3+H2O=H2SO4��
��2����Ӧ��������ֽ��������������������ˮ����Ӧ�Ļ�ѧ����ʽ��2H2SO4![]() 2SO2��+O2��+2H2O����Ӧ����Ԫ�ػ��ϼ����ߣ����������������Ԫ�ػ��ϼ۽��ͣ�SO2�ǻ�ԭ������������������뻹ԭ�����������֮����1:2��
2SO2��+O2��+2H2O����Ӧ����Ԫ�ػ��ϼ����ߣ����������������Ԫ�ػ��ϼ۽��ͣ�SO2�ǻ�ԭ������������������뻹ԭ�����������֮����1:2��
��3����Ӧ��Ϊ�绯��Ӧ����������ת��Ϊ����͵��������������Ԫ�صĻ��ϼ�����+4�۵�+6�ۺ�0�ۡ�
��4����Ӧ�����������������ɶ�������ȼ�������Dz�������������ɫ���棬���ȣ������д̼�����ζ�����塣����������ʹƷ����Һ��ɫ����������ɵĶ�������ķ����ǽ�����ͨ��Ʒ����Һ�У���һ����ټ��ȣ��۲쵽��������Ʒ����Һ��ɫ���Ҽ��Ⱥ��ָֻ�ԭɫ��
��5������ʾ��ͼ��֪��̫����ת��Ϊ���ܣ�����ת��Ϊ��ѧ�ܣ���ѧ��ת��Ϊ���ܣ�����ת��Ϊ���ܣ���������������4����ʽ������ת���������ж��������������˹����п�����ɵ�һ�ֻ������������ꡣ