题目内容
1.氟在自然界中常以CaF2的形式存在.(1)下列关于CaF2的表述正确的是bd.
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴阳离子比为2:1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是3CaF2+Al3+=3Ca2++AlF63-(用离子方程式表示).
已知AlF63-在溶液中可稳定存在.
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为V形,其中氧原子的杂化方式为sp3.
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等.已知反应Cl2(g)+3F2(g)═2ClF3(g)△H=-313kJ•mol-1,F-F键的键能为159kJ•mol-1,Cl-Cl键的键能为242kJ•mol-1,则ClF3中Cl-F键的平均键能为172kJ•mol-1.ClF3的熔、沸点比BrF3的低(填“高”或“低”).
分析 (1)a.阴阳离子间存在静电引力和静电斥力,则;
b.离子晶体的熔点与离子所带电荷、离子半径有关;
c.晶体的结构与电荷比、半径比有关;
d.离子化合物在熔融时能发生电离.
(2)F-与Al3+能形成很难电离的配离子AlF63-;
(3)根据价层电子对互斥理论分析,先计算价层电子对数,再判断中心原子的杂化类型,及分子构型;
(4)△H=反应物的总键能-生成物的总键能;相对分子质量越大,分子晶体的熔沸点越高.
解答 解:(1)a.阴阳离子间存在静电引力和静电斥力,Ca2+与F-间存在静电吸引作用,还存在静电斥力,故a错误;
b.离子晶体的熔点与离子所带电荷、离子半径有关,离子半径越小,离子晶体的熔点越高,所以CaF2的熔点高于CaCl2,故b正确;
c.晶体的结构与电荷比、半径比有关,阴阳离子比为2:1的物质,与CaF2晶体的电荷比相同,若半径比相差较大,则晶体构型不相同,故c错误;
d.CaF2中的化学键为离子键,离子化合物在熔融时能发生电离,存在自由移动的离子,能导电,因此CaF2在熔融状态下能导电,故b正确;
故答案为:bd;
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,因为在溶液中F-与Al3+能形成很难电离的配离子AlF63-,使CaF2的溶解平衡正移,其反应的离子方程式为:3CaF2+Al3+=3Ca2++AlF63-;
故答案为:3CaF2+Al3+=3Ca2++AlF63-;
(3)OF2分子中O原子的价层电子对数=2+$\frac{1}{2}$(6-2×1)=4,则O原子的杂化类型为sp3杂化,含有2个孤电子对,所以分子的空间构型为V形;
故答案为:V形;sp3;
(4)△H=反应物的总键能-生成物的总键能,设Cl-F键的平均键能为QkJ•mol-1,
则242+159×3-2×3×Q=-313,解得Q=172;
相对分子质量越大,分子晶体的熔沸点越高,已知ClF3的相对分子质量比BrF3的小,所以ClF3的熔、沸点比BrF3的低;
故答案为:172;低.
点评 本题考查了物质结构与性质,题目涉及晶体熔沸点的比较、化学键、沉淀溶解平衡、杂化理论的应用、键能与反应热 的计算等,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力.

 名校课堂系列答案
名校课堂系列答案| 选项 | 实验及现象 | 结论 |
| A | 将湿润的红色石蕊试纸放在试管口,试纸变蓝 | 反应中有NH3产生 |
| B | 收集产生的气体并点燃,火焰呈淡蓝色 | 反应中有H2产生 |
| C | 收集气体的同时测得溶液的pH为8.6 | 弱碱性溶液中Mg也可被氧化 |
| D | 将光亮的镁条放入pH为8.6的NaHCO3溶液中,有气泡产生 | 弱碱性溶液中OH-氧化了Mg |
| A. | A | B. | B | C. | C | D. | D |
CO(g)+H2S(g)?COS(g)+H2(g) K=0.1
反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是( )
| A. | 升高温度,H2S浓度增加,表明该反应是吸热反应 | |
| B. | 通入CO后,正反应速率逐渐增大 | |
| C. | 反应前H2S物质的量为7mol | |
| D. | CO的平衡转化率为80% |
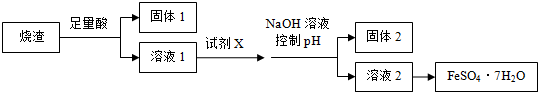
下列说法不正确的是( )
| A. | 溶解烧渣选用足量硫酸,试剂X选用铁粉 | |
| B. | 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2 | |
| C. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解 | |
| D. | 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O |
| A. | AlCl3 | B. | Na2O | C. | FeCl2 | D. | SiO2 |
| A. | CH2=CHCN | B. | CH2=CH-CH=CH2 | C. |  | D. |  |
| A. | 2CN-+Cl2→(CN)2+2Cl- | B. | (CN)2+H2O→2H++CN-+CNO- | ||
| C. | (CN)2+2OH-→CN-+CNO-+H2O | D. | (SCN)2+2CN-→2SCN-+(CN)2 |
| A. | 4种溶液pH的大小顺序:①>④>③>② | |
| B. | ①、②混合后pH>7,则混合溶液中c(NH4+)<c(NH3•H2O) | |
| C. | ①、②中分别加入25 mL 0.1 mol•L-1盐酸后,溶液中c(NH4+):①>② | |
| D. | ③、④中分别加入12.5 mL 0.1mol•L-1 NaOH溶液后,两溶液中离子种类相同 |
| A. | 为加快漂白精的漂白速率,使用时可滴加几滴醋酸 | |
| B. | 为防止海鲜腐烂,可将海鲜产品浸泡在硫酸铜溶液中 | |
| C. | 为增强治疗缺铁性贫血效果,可在口服硫酸亚铁片时同服维生素C | |
| D. | 为使水果保鲜,可在水果箱内放入高锰酸钾溶液浸泡过的硅藻土 |