题目内容
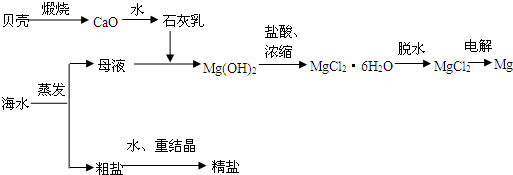
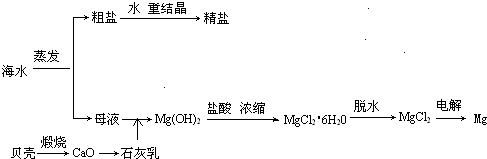
海水的综合利用可以制备金属镁,其流程如下图所示:
(1)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl或MgO,写出相应反应的化学方程式:________________________________________,用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是:________________________________________________________。
(2)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤:_______________________________________________________________。
(3)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
溶解时:_______________________________________________。
过滤时:_______________________________________________。
蒸发时:_______________________________________________。
(1)MgCl2·6H2O![]() Mg(OH)Cl+HCl↑+5H2O↑;
Mg(OH)Cl+HCl↑+5H2O↑;
MgCl2·6H2O![]() MgO+2HCl↑+5H2O
MgO+2HCl↑+5H2O
或Mg(OH)Cl![]() MgO+HCl↑
MgO+HCl↑
在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2·6H2O受热产生的水蒸气,故能得到无水MgCl2
(2)加入MgCl2溶液,充分搅拌,过滤,沉淀用水洗涤
(3)搅拌,加速溶解使待滤液体沿玻璃棒流入漏斗,防止外洒搅拌,防止因局部过热液滴或晶体飞溅
解析:(1)解答本题要结合盐类水解的知识:MgCl2·6H2O在加热失水后要发生水解,即MgCl2·6H2O![]() Mg(OH)Cl+HCl↑+5H2O↑或MgCl2·6H2O
Mg(OH)Cl+HCl↑+5H2O↑或MgCl2·6H2O![]() MgO+2HCl↑+5H2O↑
MgO+2HCl↑+5H2O↑
(2)因为Mg(OH)2难溶于水,而Ca(OH)2微溶于水,因此可加入MgCl2,使Ca(OH)2转化为Mg(OH)2和易溶的CaCl2,通过过滤即可达到目的。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案