题目内容
【题目】将CO2气体缓缓通入到含有等物质的量的KOH,Ba(OH)2和KAlO2的混合溶液中,直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示(假设每步反应均完全).下列关于整个反应进程中的各种描述不正确的是( ) 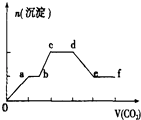
A.d~e段沉淀的减少是由碳酸钡固体的消失所致
B.b~c段反应的离子方程式是:2A1O2﹣+3H2O+CO2=2A1(OH)3↓+CO32﹣
C.0~a段反应的化学方程式是:Ba(OH)2+CO2=BaCO3↓+H2O
D.a~b段与c~d段所发生的反应相同
【答案】D
【解析】解:只要通入CO2 , 立刻就有沉淀BaCO3产生,首先发生反应Ba(OH)2+CO2=Ba CO3↓+H2O,将Ba(OH)2消耗完毕,接下来消耗KOH,发生反应2KOH+CO2=K2CO3+H2O,因而此段沉淀的量保持不变,然后沉淀量增大,发生反应2AlO2﹣+3H2O+CO2=2Al(OH)3↓+CO32﹣ , 沉淀量达最大后,再发生CO32﹣+CO2+H2O=2HCO3﹣ , 最后发生反应BaCO3+CO2+H2O=Ba(HCO3)2 , 沉淀部分溶解,A.d~e段发生反应BaCO3+CO2+H2O=Ba(HCO3)2 , 导致沉淀的减少,故A正确;
B.b~c段反应的离子方程式是:2A1O2﹣+3H2O+CO2=2A1(OH)3↓+CO32﹣ , 故B正确;
C.由上述分析可知,0~a段发生反应:Ba(OH)2+CO2=BaCO3↓+H2O,故C正确;
D.由上述分析可知,A~B段发生2KOH+CO2=K2CO3+H2O,离子方程式2OH﹣+CO2═CO32﹣+H2O,c~d段发生CO32﹣+CO2+H2O=HCO3﹣ , 可知两阶段反应不相同,故D错误;
故选D.

【题目】盐酸在不同的反应中,可以分别表现出酸性、氧化性和还原性。现在有如下三个反应,有关判断正确的是( )
①Zn+2HCl ![]() ZnCl2+H2↑;②NaOH+HCl
ZnCl2+H2↑;②NaOH+HCl ![]() NaCl+H2O;
NaCl+H2O;
③2HCl ![]() H2↑+Cl2↑
H2↑+Cl2↑
选项 | 有关判断 |
A | 反应①是置换反应,HCl表现还原性 |
B | 反应②是复分解反应,HCl表现氧化性 |
C | 反应③中HCl既表现氧化性也表现还原性 |
D | 反应①中氢原子失去电子 |
A.A
B.B
C.C
D.D