题目内容
【题目】现有下列物质:①NaCO310H2O晶体 ②铜 ③硫酸溶液 ④CO2 ⑤NaHSO4固体 ⑥Ba(OH)2固体 ⑦红褐色的氢氧化铁胶体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3固体。
(1)上述物质属于电解质的有(填编号)。
(2)上述物质中有两种物质之间可发生离子反应:H++OH-=H2O,写出该离子反应对应的化学方程式。
(3)制取⑦的化学方程式;将⑥的溶液滴加到⑤的溶液中至恰好完全沉淀时的离子方程式。
(4)17.1g⑩溶于水配成250mL溶液,SO42-的物质的量浓度为。
(5)②与⑨发生反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O当有0.6mol电子转移时,生成的气体标准状况下的体积为L。
【答案】
(1)①⑤⑥⑩
(2)2HNO3+Ba(OH)2=Ba(NO3)2+2H2O
(3)FeCl3+3H2O ![]() Fe(OH)3(胶体)+3HCl,H++SO42-+Ba2++OH-=BaSO4↓+H2O
Fe(OH)3(胶体)+3HCl,H++SO42-+Ba2++OH-=BaSO4↓+H2O
(4)0.6mol/L
(5)4.48
【解析】(1)电解质包括酸、碱、盐、活泼金属氧化物和水,单质和混合物都不是电解质,因此①NaCO310H2O晶体 ②铜 ③硫酸溶液 ④CO2 ⑤NaHSO4固体 ⑥Ba(OH)2固体 ⑦红褐色的氢氧化铁胶体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3固体,10种物质中属于电解质的有:①NaCO310H2O晶体、⑤NaHSO4固体、⑥Ba(OH)2固体、⑩Al2(SO4)3固体,所以答案是:①⑤⑥⑩;(2)H++OH-═H2O,表示可溶性强酸或者强酸的酸式盐与可溶性强碱反应生成可溶性盐和水,可以表示氢氧化钡与硝酸的反应,方程式:Ba(OH)2+2HNO3═Ba(NO3)2+2H2O;所以答案是:Ba(OH)2+2HNO3═Ba(NO3)2+2H2O;(3)实验室制取氢氧化铁胶体的化学方程式为FeCl3+3H2O ![]() Fe(OH)3(胶体)+3HCl,氢氧化钡与硫酸氢钠按照物质的量之比1:1反应,硫酸根离子恰好沉淀完全,离子方程式:H++SO42-+Ba2++OH-═BaSO4↓+H2O;所以答案是:FeCl3+3H2O
Fe(OH)3(胶体)+3HCl,氢氧化钡与硫酸氢钠按照物质的量之比1:1反应,硫酸根离子恰好沉淀完全,离子方程式:H++SO42-+Ba2++OH-═BaSO4↓+H2O;所以答案是:FeCl3+3H2O ![]() Fe(OH)3(胶体)+3HCl;H++SO42-+Ba2++OH-═BaSO4↓+H2O;(4)硫酸铝是强电解质,能完全电离,电离方程式为:Al2(SO4)3=2Al3++3SO42-,17.1gAl2(SO4)3溶于水配成250mL溶液,SO42-的物质的量为
Fe(OH)3(胶体)+3HCl;H++SO42-+Ba2++OH-═BaSO4↓+H2O;(4)硫酸铝是强电解质,能完全电离,电离方程式为:Al2(SO4)3=2Al3++3SO42-,17.1gAl2(SO4)3溶于水配成250mL溶液,SO42-的物质的量为 ![]() =0.05mol,SO42-的物质的量浓度c=
=0.05mol,SO42-的物质的量浓度c= ![]() =
= ![]() =0.6mol/L,所以答案是:0.6mol/L;(5)在参加反应的8mol硝酸中,被还原的硝酸的物质的量为2mol,生成NO的物质的量是2mol,转移电子是6mol,若反应中转移了0.6mol电子,产生的气体的物质的量是0.2mol,在标准状况下的体积是0.2mol×22.4L/mol=4.48L,所以答案是:4.48。
=0.6mol/L,所以答案是:0.6mol/L;(5)在参加反应的8mol硝酸中,被还原的硝酸的物质的量为2mol,生成NO的物质的量是2mol,转移电子是6mol,若反应中转移了0.6mol电子,产生的气体的物质的量是0.2mol,在标准状况下的体积是0.2mol×22.4L/mol=4.48L,所以答案是:4.48。
【考点精析】本题主要考查了物质的量浓度的概念的相关知识点,需要掌握以单位体积里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度;符号CB=nB(mol)/V(L) (nB是溶质B的物质的量,V是溶液体积),单位是mol·Lˉ1才能正确解答此题.

 名校课堂系列答案
名校课堂系列答案【题目】下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)( )
a | b | c | d | |
① | Si | SiO2 | H2SiO3 | Na2SiO3 |
② | N2 | NO | NO2 | HNO3 |
③ | Cu | CuO | Cu(OH)2 | CuSO4 |
④ | Na | NaOH | Na2CO3 | NaHCO3 |
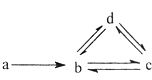
A.①②
B.②③
C.③④
D.②④