题目内容
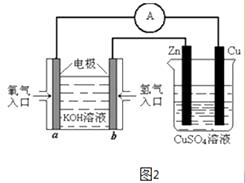
【题目】利用反应Zn+Cu2+= Zn2++ Cu设计成原电池。则该电池的负极、正极和电解质溶液选择合理的是
A. Zn、Cu、ZnSO4B. Cu、Zn、 ZnCl2
C. Cu、Zn、CuCl2D. Zn、Cu、CuSO4
【答案】D
【解析】
利用反应Zn+Cu2+=Zn2++Cu设计成原电池,由于反应中锌失去电子,铜离子得电子,则该电池的负极一定是锌,正极是金属性弱于锌的金属或能导电的非金属,而电解质溶液中含有铜离子,则选择合理的是Zn、Cu、CuSO4。答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】雯雯在自学碳酸钠性质时,查到了以下资料:
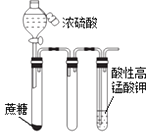
①CO2+Na2CO3+H2O=2NaHCO3 , CO2通入饱和碳酸钠溶液会产生白色沉淀,CO2不溶于饱和碳酸氢钠溶液。
②碳酸钠、碳酸氢钠在不同温度下的溶解度如表:
0 ℃ | 10 ℃ | 20 ℃ | 30 ℃ | |
Na2CO3 | 7.1 | 12.2 | 21.8 | 39.7 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 |
【进行实验1】验证CO2通入饱和碳酸钠溶液会产生白色沉淀
①配制碳酸钠溶液:取100 g 20 ℃的水,加入35 g碳酸钠固体,搅拌后,静置,取上层清液。
②利用装置一进行实验,连续5分钟向新制得的碳酸钠溶液中通入CO2。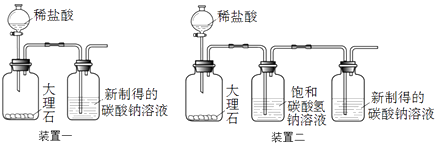
【发现问题】实验中,始终没有看到沉淀现象,原因是什么呢?雯雯进行了以下实验探究。
【进行实验2】
实验操作 | 实验现象 |
①取100 g 20 ℃的水,加入35 g碳酸钠固体,搅拌后,静置,取上层清液 | 没有出现白色沉淀 |
(1)在0 ℃~30 ℃,Na2CO3和NaHCO3的溶解度受温度变化影响较大的是。
(2)大理石与稀盐酸反应的离子方程式为。
(3)装置二中饱和碳酸氢钠溶液的作用是。
(4)【进行实验3】
实验操作 | 实验现象 |
①取100 g热开水,加入35 g碳酸钠固体,完全溶解,再降温至20 ℃,取上层清液 | 装置一和装置二中的碳酸钠溶液中均出现白色沉淀 |
雯雯在最初的实验中没有看到沉淀现象的原因是。
(5)CO2通入饱和碳酸钠溶液会产生白色沉淀的原因是。