题目内容
10.下列有关实验现象或亊实解释正确的是 ( )| 选项 | 实验现象或事实 | 解释 |
| A | 检验待测液中SO42-时,先滴入稀盐酸,再滴入BaCl2溶液 | 先滴入盐酸可排除Ag+、CO32-、SO32-等离子干扰 |
| B | 制备乙酸乙酯时,导管应伸入试管至饱和Na2CO3溶液液面上方 | 乙酸乙酯易溶于碳酸钠溶液,防止发生倒吸 |
| C | 向Fe(NO3)2溶液中加入稀硫酸,试管口有红棕色气体产生 | 溶液中NO3-被Fe2+还原为NO2 |
| D | 含Mg(HCO3)2的硬水长时间充分加热,最终得到的沉淀物的主要成分为Mg(OH)2,而不是MgCO3 | Ksp(MgCO3)<Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
分析 A.加盐酸排除干扰离子;
B.乙酸乙酯不溶于水;
C.向Fe(NO3)2溶液中加入稀硫酸,硝酸根离子在酸性条件具有强氧化性;
D.最终得到的沉淀物的主要成分为Mg(OH)2,而不是MgCO3,氢氧化镁更难溶.
解答 解:A.加盐酸排除干扰离子,再滴入BaCl2溶液,生成白色沉淀可检验硫酸根离子,故A正确;
B.乙酸乙酯不溶于水,乙酸与碳酸钠反应,乙醇与水互溶,碳酸钠可降低乙酸乙酯的溶解度,解释不合理,故B错误;
C.向Fe(NO3)2溶液中加入稀硫酸,硝酸根离子在酸性条件具有强氧化性,则溶液中NO3-被Fe2+还原为NO,然后NO被氧化生成NO2,故C错误;
D.最终得到的沉淀物的主要成分为Mg(OH)2,而不是MgCO3,氢氧化镁更难溶,则Ksp(MgCO3)>Ksp[Mg(OH)2],故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及离子的检验、氧化还原反应、物质制备实验等,把握实验原理、实验操作为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
20.下列物质的用途错误的是( )
| A. | 硅是制造太阳能电池的常用材料 | B. | 二氧化硅是制造光导纤维的材料 | ||
| C. | 水玻璃可用作木材防火剂 | D. | 二氧化硅可以做砂纸、砂轮的磨料 |
1.用惰性电极实现电解,下列说法正确的是( )
| A. | 电解NaOH溶液,要消耗OH-,故溶液pH减小 | |
| B. | 电解H2SO4溶液,实质上是电解水,故溶液pH不变 | |
| C. | 电解CuCl2溶液,在阴极和阳极上析出产物的物质的量之比为1:1 | |
| D. | 电解Na2SO4溶液,在阴极和阳极上析出产物的物质的量之比为1:2 |
18.在一定温度下可逆反应2NO2(g)═2NO(g)+O2(g)在体积固定的密闭容器中反应,下列叙述能够说明该反应已经达到平衡状态的是( )
| A. | 单位时间内生成amol O2的同时生成2amol NO的状态 | |
| B. | NO2、NO、O2三者物质的量之比为2:2:1的状态 | |
| C. | 混合气体的密度不随时间变化而变化的状态 | |
| D. | 混合气体的平均相对分子质量不随时间变化而变化的状态 |
5.有A、B两种有机物各取1mol在足量氧气中充分燃烧,分别生成7mol和3molCO2.只要A、B的总物质的量一定,不论A、B以任意物质的量之比混合,或只要A、B的总质量一定,不论A、B以任意质量之比混合,充分燃烧后生成水的量为一定值,已知A是苯的同系物,则B的分子式为( )
| A. | C3H6O | B. | C3H8O3 | C. | C3H8O2 | D. | C3H8O |
15.某品牌消毒液的商品标识上注明:
①本品为无色液体呈碱性;
②使用时应加水稀释;
③可对餐具进行消毒,并能漂白浅色衣物.
据此判断其有效成分可能是( )
①本品为无色液体呈碱性;
②使用时应加水稀释;
③可对餐具进行消毒,并能漂白浅色衣物.
据此判断其有效成分可能是( )
| A. | Cl2 | B. | SO2 | C. | H2O2 | D. | NaClO |
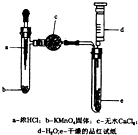 某化学实验小组为探究氯气漂白原理,设计了以下实验装置:
某化学实验小组为探究氯气漂白原理,设计了以下实验装置: