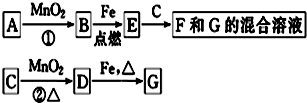
题目内容
2.有CO、H2、HCHO(甲醛)三种混合气体12g,在足量O2中完全燃烧后,将生成的产物全部通入过量的Na2O2,充分吸收后,固体增加的质量是( )| A. | 14.2 g | B. | 16.7 g | C. | 12.6g | D. | 12 g |
分析 CO在氧气中完全燃烧生成CO2,CO2再与Na2O2反应,方程式为2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2、2CO2+2Na2O2=2Na2CO3+O2,总方程式为:CO+Na2O2=Na2CO3,可知过氧化钠增重为CO的质量;
H2在氧气中完全燃烧生成H2O,H2O再与Na2O2反应,方程式为2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O、2H2O+2Na2O2=4NaOH+O2,总反应方程式为:H2+Na2O2=2NaOH,可知反应后固体质量增加为氢气质量;
由上述分析可知,CO、氢气混合气体燃烧产物再通过过氧化钠,过氧化钠固体质量的增加量就是原混合气体中CO、H2的质量和,有机物组成可以改写为(CO)x.yH2形式,相当于CO、氢气混合,燃烧产物再通过过氧化钠,固体质量的增加量就是有机物蒸气的质量.
解答 解:CO在氧气中完全燃烧生成CO2,CO2再与Na2O2反应,方程式为2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2、2CO2+2Na2O2=2Na2CO3+O2,总方程式为:CO+Na2O2=Na2CO3,可知过氧化钠增重为CO的质量;
H2在氧气中完全燃烧生成H2O,H2O再与Na2O2反应,方程式为2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O、2H2O+2Na2O2=4NaOH+O2,总反应方程式为:H2+Na2O2=2NaOH,可知反应后固体质量增加为氢气质量;
由上述分析可知,CO、氢气混合气体燃烧产物再通过过氧化钠,过氧化钠固体质量的增加量就是原混合气体中CO、H2的质量和,HCHO可以改写为CO.H2,相当于CO、氢气混合,燃烧产物再通过过氧化钠,固体质量的增加量就是HCHO的质量,故固体质量增重为12g,
故选:D.
点评 本题考查混合物的计算,侧重于学生的分析能力和计算能力的考查,难度中等,注意从CO2、H2O与Na2O2生成固体质量的变化分析规律.

 阅读快车系列答案
阅读快车系列答案| 物质 | 微粒数 | 质量(g) | 物质的量(mol) | 摩尔质量(g/mol) |
| O2 | 16 | |||
| HNO3 | 6.02×1022 | |||
| NaOH | 0.25 | |||
| Fe2+ | 28 | |||
| MgCl2 | 1.204×1024 |
| A. | MgBr2和KCl | B. | Cl2和HCl | C. | HI和NaI | D. | Na2O2和H2O2 |
| A. | 醋酸溶液和大理石中的CaCO3反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O-→C6H5OH+HCO3- | |
| C. | 澄清石灰水与过量NaHCO3溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | 硫化钠水溶液呈碱性的原因:S2-+2H2O?H2S↑+2OH- |
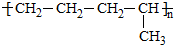

 CH3COOCH(CH3)CH2OOCCH3+2H2O
CH3COOCH(CH3)CH2OOCCH3+2H2O
 ,写出苯甲醇含苯环的所有同分异构体
,写出苯甲醇含苯环的所有同分异构体 、
、 、
、 、
、 .
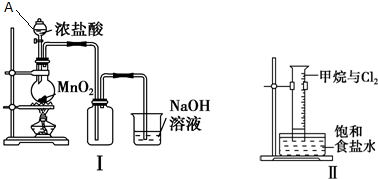
.
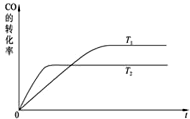 工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g),现在实验室模拟该反应并进行分析.如图是该反应在不同温度下CO的转化率随时间变化的曲线.
工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g),现在实验室模拟该反应并进行分析.如图是该反应在不同温度下CO的转化率随时间变化的曲线.