题目内容
【题目】温度为T时,向VL的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)![]() C(s)+xD(g) △H>0,容器中A、B、D的物质的量浓度随时间的变化如下图所示。下列说法中不正确的是
C(s)+xD(g) △H>0,容器中A、B、D的物质的量浓度随时间的变化如下图所示。下列说法中不正确的是

A.反应在前10min以B物质表示的平均反应速率v(B)=0.15 mol·L-1·min-1
B.该反应方程式中的x=2
C.若平衡时保持温度不变,压缩容器容积,平衡向逆反应方向移动
D.反应至15min时,改变的条件是降低温度
【答案】C
【解析】
A. 反应在前10min以B物质表示的平均反应速率![]() (B) =
(B) =![]() 0.15 mol·L-1·min-1,故A正确;
0.15 mol·L-1·min-1,故A正确;
B. 反应方程式各物质的变化量比等于系数比,![]() ,该反应方程式中的x=2,故B正确;
,该反应方程式中的x=2,故B正确;
C. x=2,反应前后气体系数和不变,若平衡时保持温度不变,压缩容器容积,平衡不移动,故C错误;
D. A(g)+B(g)![]() C(s)+2D(g) 正反应吸热,根据图象可知,反应至15min时,平衡逆向移动,所以改变的条件是降低温度,故D正确;
C(s)+2D(g) 正反应吸热,根据图象可知,反应至15min时,平衡逆向移动,所以改变的条件是降低温度,故D正确;
答案选C。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】在煤的化工生产中,我们常常需要研究不同温度下的平衡常数、投料比及产率等问题。已知CO(g)+H2O(g) ![]() H2(g)+CO2(g)的平衡常数随温度的变化如下表,
H2(g)+CO2(g)的平衡常数随温度的变化如下表,
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数/K | 10 | 9 | 1 | 0.6 |
试回答下列问题:
(1)上述反应的正反应是___________反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率_________(填“增大”、“减小”或“不变”),容器内混合气体的压强___________(填“增大”、“减小”或“不变”)。
(3)830 ℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有_______________(选填字母)。
投料 | A | B | C | D |
n(CO2)/mol | 3 | 1 | 0 | 1 |
n(H2)/mol | 2 | 1 | 0 | 1 |
n(CO)/mol | 1 | 2 | 3 | 0.5 |
n(H2 | 5 | 2 | 3 | 2 |
(4)在830 ℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g),2min达到平衡时,CO的转化率为____________,用CO2表示的平均反应速率V(CO2)为_____________。
【题目】某研究小组为探究弱酸性条件下铁发生电化学腐蚀的类型及腐蚀速率,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞,如图 1 所示。 从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
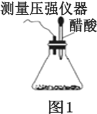
(1)请完成以下实验设计(完成表中空格):
编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
② | ______________ | 0.5 | ____________ | 36.0 |
③ | 碳粉含量的影响 | 0.2 | 2.0 | 90.0 |
(2)编号①实验测得容器中压强随时间变化如图 2。 t2 时,容器中压强明显小于起始压强, 其原因是铁发生了_____腐蚀, 请在图 3 中用箭头标出发生该腐蚀时电子流动方向_____;此时,碳粉表面发生了_____(填“氧化”或“还原”)反应,其电极反应式是_____。
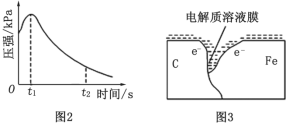
(3)该小组对图 2 中 0~t1 时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:_____。