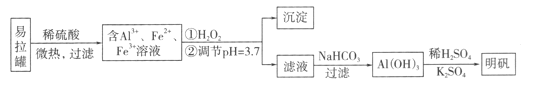
题目内容
【题目】己知重铬酸钾在水溶液中存在如下平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙红色)+H2O。下列说法正确的是
Cr2O72-(橙红色)+H2O。下列说法正确的是
A. 当溶液的pH降低时,平衡向左移动
B. 恒温下,将上述溶液用蒸馏水稀释到原体积的2倍,平衡向右移动
C. 当溶液颜色不变时,溶液的c(H+)/c(OH-)是一个定值
D. 增大CrO42-浓度,平衡向右移动,平衡常数增大
【答案】C
【解析】A. 当溶液的pH降低时,氢离子浓度增大,所以平衡向右移动,A错误;B. 恒温下,将上述溶液用蒸馏水稀释到原体积的2倍,反应物浓度降低的程度更大,平衡向左移动,B错误;C. 当溶液颜色不变时反应达到平衡状态,溶液的c(H+)/c(OH-)是一个定值,C正确;D. 增大CrO42-浓度,平衡向右移动,但温度不变,平衡常数不变,D错误,答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】CO2的回收与利用是科学家研究的热点课题。可利用CH4与CO2制备合成气(CO、H2),还可制备甲醇、二甲醚、低碳烯经等燃料产品。
I.科学家提出制备“合成气”反应历程分两步:
反应①:CH4(g)C(ads) +2H2(g) (慢反应)
反应②:C(ads) + CO2(g)2CO(g) (快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:
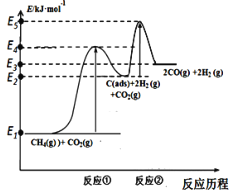
(1)CH4与CO2制备合成气的热化学方程式为____________:该反应在高温下可自发正向进行的原因是_________,能量变化图中:E5+E1___E4+E2(填“>”、“<”或“=”)。
II.利用“合成气”合成申醇后,脱水制得二甲醚。
反应为:2CH3OH(g)CH3OCH3 (g) + H2O(g) △H
经查阅资料,在一定范围内,上述反应化学平衡常数与热力学温度存在如下关系:lnKc=-2.205+![]() 。其速率方程为:v正=k正c2(CH3OH),v逆=k逆c(CH3OCH3)c(H2O),k正、K逆为速率常数,且影响外因只有温度。
。其速率方程为:v正=k正c2(CH3OH),v逆=k逆c(CH3OCH3)c(H2O),k正、K逆为速率常数,且影响外因只有温度。
(2)反应达到平衡后,仅升高温度,k正增大的倍数________ k逆增大的倍数(填“>”、“<”或“= ”)。
(3)某温度下,Kc=200,在密闭容器中加入一定量CH3OH。反应到某时刻测得各组分的物质的量如下:
物质 | CH3OH | CH3OCH3 | H2O |
物质的量/mol | 0.4 | 0.4 | 0.4 |
此时正、逆反应速率的大小:v正 ____v逆(填“>”、“<”或“=”)。
(4)500K下,在密闭容器中加入一定量甲醇CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为_____(埴标号)
A.![]() B.
B.![]() C.
C.![]() D.无法确定
D.无法确定
Ⅲ.合成低碳烯经
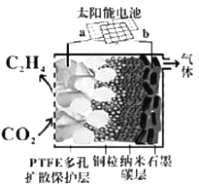
(5)强碱性电催化还原CO2制备乙烯研究取得突破进展,原理如图所示。b极接的是太阳能电池的_______极(已知PTFE浸泡了饱和KCl溶液)。请写出阴极的电极反应式______。