题目内容
【题目】氮的化合物在化肥、医药、炸药、材料等领域中有着极其重要用途。
(1)羟氨能与溴化银悬浊液反应:2NH2OH+2AgBr=N2↑+2Ag+2HBr+2H2O,羟氨的电子式为________;反应中烃氨表现________性.
(2)已知:a.N2(g)+3H2(g)=2NH3(g) △H=-92.2kJ/mol
b.H2(g)+Cl2(g)=2HCl(g) △H=-184.6kJ/mol
c.2NH3(g)+3Cl2(g)=N2(g)+6HCl(g) △H3
①△H3________.
②反应c在常温下能快速进行的原因为________.
(3)容积均为1L的甲、乙两个容器,其中甲为绝热容器,乙为恒温容器.相同温度下,分别充入0.2mol的NO2,发生反应:2NO2(g)≒N2O4(g) △H<0,甲中NO2的相关量随时间变化如下图所示。
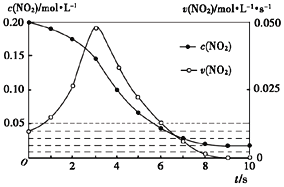
①0~3S内,甲容器中NO2的反应速率增大的原因是________.
②甲达平衡时,温度若为T℃,此温度下的平衡常数Kc=________.
③平衡时,K甲________K乙(填“>”、“<”或“=”,下同),P甲________P乙
(4)化学工作者对NO与H2的反应进行研究,提出下列3步机理:(k为速率常数)
第一步2NO=N2O2 快反应,平衡时:V正=K正·c2(NO)=V逆=K逆·c(N2O2)
第二步N2O2+H2==N2O+H2O 慢反应 第三步N2O+H2=N2+H2O 快反应
其中可近似认为第二步反应不影响第一步平衡,下列说法正确的是________.(填字母标号)
A.V(第一步逆反应)<V(第二步反应) B.总反应快慢主要由第二步反应决定
C.达平衡时,2c(NO)=c(N2O2) D.第一步反应的平衡常数K= K正/ K逆
【答案】![]() 还原 -461.6 kJ/mol 该反应的活化能较小或反应物分子中共价键的键能较小 0-3s内温度升高对速率的影响大于浓度降低的影响 225 < > BD
还原 -461.6 kJ/mol 该反应的活化能较小或反应物分子中共价键的键能较小 0-3s内温度升高对速率的影响大于浓度降低的影响 225 < > BD
【解析】
第(1)问中由羟氨结构写出电子式,结合化合价变化确定其性质;第(2)问从盖斯定律计算分析;第(3)(4)问为平衡常数计算,及影响平衡因素进行分析。
(1)由其分子式可推出电子式为![]() ,反应中N化合价升高,烃氨表现还原性;
,反应中N化合价升高,烃氨表现还原性;
(2)①设a式反应热为△H1,b式反应热为△H2,则由盖斯定律,△H3=3△H2-△H1=-184.6×3-(-92.2)=-461.6 kJ/mol;②常温下能快速进行,其原因可能是该反应的活化能较小或反应物分子中共价键键能较小;
(3)①该反应为放热反应,故0-3s内温度升高对速率的影响大于浓度降低的影响,导致反应速率增大;②到达平衡时,c(NO2)=0.02mol/L,c(N2O4)=0.09mol/L,K=0.09/0.022=225;③甲为绝热容器,乙为恒温容器,该反应为放热反应,则到达平衡时甲的温度高于乙,故K甲<K乙,甲中反应正向进行的程度小于乙,甲中气体的总物质的量大于乙,故P甲>P乙;
(4)A.第二步为慢反应,故其反应速率应小于第一步,A项错误;总反应快慢应由慢反应决定,即主要由第二步反应决定,B项正确;C. 到达平衡时K正·c2(NO)=K逆·c(N2O2),K正、K逆值未知,故两者浓度大小关系未知,C项错误;D.达到平衡时,K= c(N2O2)/ c2(NO),又V正=K正·c2(NO)=V逆=K逆·c(N2O2), 故K= K正/ K逆,D项正确。

 阅读快车系列答案
阅读快车系列答案