题目内容
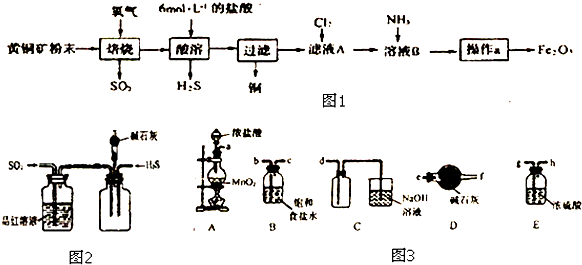
2.某同学为研究硝酸与镁的反应,进行如图实验,实验现象及相关数据如下:(a)A中为一定浓度的硝酸与Mg片发生反应,生成的气体通过B后,在B中只生成一种盐,剩余气体遇空气不变色,其体积为原体积的一半.
(b)从C进入D中的气体有两种,且体积比为1:1.
(c)将D加热一段时间后,E中干燥的红色石蕊试纸逐渐恋蓝.(设实验前,装置中的空气已排尽;气体的体积均在同温同压下测定)
已知:2NO2+2NaOH=NaNO3+NaNO2+H2O,NO2+NO+2NaOH=2NaNO2+H2O,且水蒸气的体积忽略不计,实验中的液体药品均过量.请回答:
(1)硝酸与Mg片反应生成的气体成分是NO、NO2、N2、H2(用化学式表示).
(2)硝酸在装置A的反应中所表现的性质有酸性、氧化剂.
分析 NO2气体与NaOH溶液反应的化学方程式为2NO2+2NaOH=NaNO3+NaNO2+H2O,NO与NaOH溶液不反应,但有NO2,发生反应NO2+NO+2NaOH=2NaNO2+H2O,A产生的气体通入B中,在B中只生成一种盐,剩余气体遇空气不变色,说明A产生的气体中有NO和NO2两种气体且两者的比例为1:1;结合(c)可知D中生成的气体是NH3,同时有水生成,反推知由N2和H2合成,即进入D中的气体为N2和H2,二者体积之比为1:1,二者体积之和等于NO和NO2两种气体的体积之和,故Mg和HNO3反应生成的气体有NO、NO2、N2、H24种,且物质的量相等,据此解答.
解答 解:NO2气体与NaOH溶液反应的化学方程式为2NO2+2NaOH=NaNO3+NaNO2+H2O,NO与NaOH溶液不反应,但有NO2,发生反应NO2+NO+2NaOH=2NaNO2+H2O,A产生的气体通入B中,在B中只生成一种盐,剩余气体遇空气不变色,说明A产生的气体中有NO和NO2两种气体且两者的比例为1:1;结合(c)可知D中生成的气体是NH3,同时有水生成,反推知由N2和H2合成,即进入D中的气体为N2和H2,二者体积之比为1:1,二者体积之和等于NO和NO2两种气体的体积之和,故Mg和HNO3反应生成的气体有NO、NO2、N2、H24种,且物质的量相等,
(1)由上述分析可知,硝酸与Mg片反应生成的气体成分是NO、NO2、N2、H2,
故答案为:NO、NO2、N2、H2;
(2)反应中硝酸中氮元素在产物中存在与硝酸镁、硝酸铵、NO、NO2、N2中,N元素化合价表示为变化,部分解答,故反应中硝酸起酸性、氧化剂作用,
故答案为:酸性、氧化剂.
点评 本题以实验形式考查无机物推断,需要学生对信息进行利用,需要学生具有扎实的基础与综合运用能力,对学生的逻辑推理具有较高的要求,本题关键是确定每与硝酸反应的产物确定,难度很大,为易错题目.

 阅读快车系列答案
阅读快车系列答案用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
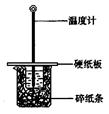
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 (填“偏大”、“偏小”、“无影响”,下同) 若用KOH代替NaOH,测定结果会 __ __
(5)他们记录的实验数据如下:
实 验 用 品 | 溶 液 温 度 | 中和热△H | |||
t1 | t2 | ||||
① | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.3℃ | |
② | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.5℃ | |
已知反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均为1g·cm-3。
①计算完成上表。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧化Cu”,并设计实验进行探究.已知:
| 水解反应 | 平衡常数(K) |
| Fe3++3H2O?Fe(OH)3+3H+ | 7.9×10-4 |
| Fe2++2H2O?Fe(OH)2+2H+ | 3.2×10-10 |
| Cu2++2H2O?Cu(OH)2+2H+ | 3.2×10-7 |
试剂:0.5mol/L Fe(NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、5mol/L硝酸钠溶液、0.5mol/L硝酸钠溶液、0.1mol/L稀盐酸、蒸馏水.
方案测定硝酸铁溶液的pH,再用硝酸钠溶液和稀盐酸配制成与硝酸铁溶液PH相同、硝酸根离子浓度相同的溶液,将铜片加入到该溶液中,观察二者是否反应.
(2)丙同学分别实施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH的变化,实验记录如下.
| 实验内容 | 实验现象 |
| 甲同学的实验方案 | 溶液逐渐变成蓝绿色,pH略有上升 |
| 乙同学的实验方案 | 无明显现象,pH没有明显变化. |
②导致实验过程中溶液pH略有上升的可能原因是Fe3+变为Cu2+和Fe2+,水解能力下降.
③解释乙同学的实验现象在此酸性条件下NO3-不能氧化Cu.
(3)请你设计更简便可行的实验方案,帮助甲同学达到实验目的将铜片放入0.5mol/L氯化铁溶液中.
Ⅱ.聚合氯化铁铝(简称PAFC),其化学通式为[FexAly(OH)aClb•zH2O]m.某同学为测定其组成,进行如下实验:①准确称取4.505 0g样品,溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到2.330 0g固体.②另准确称取等质量样品溶于水,在溶液中加入适量Zn粉和稀硫酸,将Fe3+完全还原为Fe2+.用0.100 0mol•L-1标准KMnO4溶液滴定Fe2+,消耗标准溶液的体积为20.00mL.③另准确称取等质量样品,用硝酸溶解后,加入足量AgNO3溶液,得到4.305 0g白色沉淀.(相对原子质量或式量:Fe-56 Al-27 Cl-35.5 O-16 H-1 Fe2O3-160 Al2O3-102 AgCl-143.5 H2O-18)
(4)若滴定管在使用前未用KMnO4标准溶液润洗,测得的Al3+含量将偏低(填“偏高”“偏低”或“不变”).
(5)通过计算确定PAFC的化学式[FeAl3(OH)9Cl3•3H2O]m或FeAl3(OH)9Cl3•3H2O(写出计算过程;不要求写出反应方程式;m为聚合度,不必求出).
| 选项 | 操作 | 现象 | 结论 |
| A | 将足量的乙烯通入到溴水中 | 溴水褪色 | 乙烯与溴水反应生成无色物质 |
| B | 往CaCl2溶液中通入足量的CO2 | 先有白色沉淀生成,后沉淀溶解 | CaCO3不溶于水,Ca(HCO3)2可溶于水 |
| C | 将铜板电路投入FeCl3溶液中 | 铜溶于FeCl3溶液 | 氧化性:Fe3+>Cu2+ |
| D | 取久置的Na2O2粉末,向其中滴加足量的盐酸 | 产生无色气体 | Na2O2已变质为Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
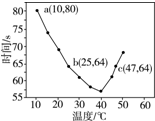
| A. | 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 | |
| B. | 图中b、c两点对应的NaHSO3的反应速率相等 | |
| C. | 图中a点对应的NaHSO3的反应速率为5.0×10-5 mol•(L•s)-1 | |
| D. | 温度高于40℃时,淀粉不宜用作该实验的指示剂 |
| A. | 一定有甲烷 | B. | 一定有乙烷 | C. | 一定无甲烷 | D. | 可能有乙烯 |
| A. | 硝酸钠和金刚石 | B. | 冰和干冰 | C. | 晶体硅和水晶 | D. | 萘和苯 |
 C2H4(g)①
C2H4(g)①