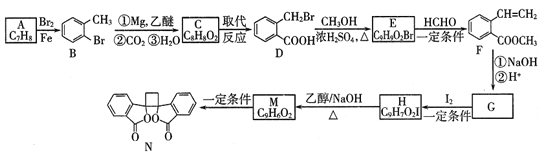
题目内容
【题目】(题文)溶质的质量分数为14%的KOH溶液,经加热蒸发去100g水后,质量分数变成28%,体积为80mL,则此时溶液的物质的量浓度为
A. 5mol/L B. 6mol/L C. 6.25mol/L D. 6.75mol/L
【答案】C
【解析】
根据蒸发前后溶质的质量不变,计算出原溶液的质量,根据m(溶质)=m(溶液)ω计算溶质质量,根据n=![]() 计算溶质KOH的物质的量,进而根据c=
计算溶质KOH的物质的量,进而根据c=![]() 计算溶液的物质的量浓度。
计算溶液的物质的量浓度。
设14%氢氧化钾溶液的质量为x,蒸发前后溶质的质量不变,则:
x×14%=(x-100g)×28%,解得:x=200g,
28%的氢氧化钾溶液中含有氢氧化钾的物质的量为:![]() =0.5mol,
=0.5mol,
所得溶液的物质的量浓度为:c=![]() =
=![]() =6.25mol/L,
=6.25mol/L,
故选C。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)科学家提出由CO2制取C的太阳能工艺如右图所示。
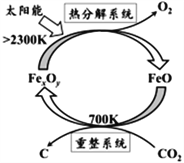
若“重整系统”发生的反应中![]() =6,则FexOy的化学式为_________________,“热分解系统”中每分解lmolFexOy,转移电子的物质的量为________________________。
=6,则FexOy的化学式为_________________,“热分解系统”中每分解lmolFexOy,转移电子的物质的量为________________________。
(2)二氧化碳催化加氢合成低碳烯烃是目前研究的热门课题。
在一个2L密闭恒容容器中分别投入1.5molCO2、5.0molH2,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右图所示。
C2H4(g)+4H2O(g) ΔH;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右图所示。

①该反应的ΔH_________0 (填“>”“<”或“不能确定”);
②在TA温度下的平衡常数K=__________________。
③提高CO2的平衡转化率,除改变温度外,还可采取的措施是:_______________________ (列举一项)。
④在TA温度下,其他条件不变,起始时若按1molCO2、2molH2、 lmolC2H4(g)、2molH2O(g)进行投料,此时v(正)________v(逆)。(填“>”“<”或“=”)。
(3) 用氨水吸收CO2制化肥碳铵(NH4HCO3)。
①已知:NH3·H2O(aq)![]() NH4+(aq)+OH-(aq) ΔH1= a kJ/mol
NH4+(aq)+OH-(aq) ΔH1= a kJ/mol
CO2(g)+H2O(1)![]() H2CO3(aq) ΔH2= b kJ/mol
H2CO3(aq) ΔH2= b kJ/mol
H2CO3(aq)+OH-(aq)![]() HCO3-(aq) +H2O(1) ΔH3= c kJ/mol
HCO3-(aq) +H2O(1) ΔH3= c kJ/mol
则利用NH3·H2O吸收CO2制备NH4HCO3的热化学方程式为____________________________;
②己知常温下相关数据如表:
Kb(NH3·H2O) | 2×10-5 |
Ka1(H2CO3) | 4×10-7 |
Ka2(H2CO3) | 4×10-11 |
则反应NH4++ HCO3-+H2O![]() NH3·H2O +H2CO3的平衡常数K=________________。
NH3·H2O +H2CO3的平衡常数K=________________。