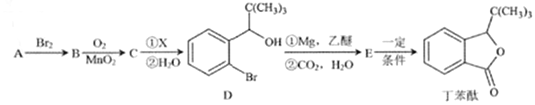
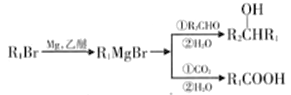
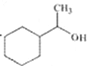
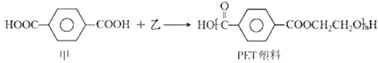题目内容
【题目】短周期主族元素M、X、Y、Z、W的原子序数依次增大,X和Z同主族,M和Z原子的最外层电子数均为各自所在周期数的2倍,Y的单质燃烧火焰呈黄色。下列推断正确的是
A. 简单离子的半径:Y<Z<W
B. 最简单氢化物的沸点:X<Z<W
C. 最高价氧化物对应水化物溶液的pH:W<Z<M
D. 化合物Y2M2中既有离子键也有共价键
【答案】D
【解析】“短周期原子最外层电子数为所在周期数的2倍”的包括C和S,则M为C元素,Z为S元素,则W只能是Cl元素;X和Z同主族,因此X为O元素;根据Y燃烧火焰为黄色判断Y为Na元素。A、Na+、S2-、Cl-离子中,Na+只有两个电子层半径最小,S2-、Cl-个有三个电子层半径比较大,而S、Cl的核电荷数分别为16、17,所以核电荷数较多的Cl-半径更小,正确顺序为S2->Cl->Na+,A错误。B、O、S、Cl的氢化物依次是H2O、H2S、HCl,都属于共价化合物,H2O分子间存在氢键所以沸点最高,而H2S的相对分子质量小于HCl,所以HCl沸点比H2S高,它们沸点的顺序为H2O>HCl>H2S,B错误。C、C、S、Cl的非金属性逐渐增强,所以最高价氧化物的水化物酸性逐渐增强,HClO4>H2SO4>H2CO3,但是由于溶液浓度未知,所以pH无法比较,C错误。D、化合物Y2M2为Na2C2,其结构为![]() ,因此既有离子键也有共价键,D正确。正确答案D。
,因此既有离子键也有共价键,D正确。正确答案D。

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目