题目内容
【题目】用菱锰矿(主要含MnCO3、FeCO3、Al2O3、SiO2)制备MnSO4·H2O的工艺流程如下:
Ⅰ.向菱锰矿中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量MnO2,过滤;
Ⅲ.调节滤液pH=a,过滤;
Ⅳ.浓缩、结晶、分离、干燥得到产品;
Ⅴ.检验产品纯度。
(1)步骤Ⅰ中,滤渣的主要成分是 。
(2)将MnO2氧化Fe2+的离子方程式补充完整:
MnO2 + ![]() Fe2+ +
Fe2+ +![]() =
=![]() Mn2+ +
Mn2+ + ![]() Fe3+ +
Fe3+ +![]()
(3)与选用Cl2作为氧化剂相比,MnO2的优势主要在于:原料来源广、成本低、可避免环境污染、 。
(4)已知:生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 | 7.6 |
完全沉淀时 | 4.7 | 8.3 | 2.8 | 10.2 |
注:金属离子的起始浓度为0.1mol/L
步骤Ⅲ中a的取值范围是 。
(5)步骤Ⅴ,通过测定产品中锰元素的质量分数来判断产品纯度。
已知一定条件下,MnO4-与Mn2+反应生成MnO2 。取x g产品配成溶液,用0.1mol/L KMnO4溶液滴定,消耗KMnO4溶液y mL,产品中锰元素的质量分数为 (用含x、y表示)
【答案】(1)SiO2(2)1、2、4H+、1、2、2H2O
(3)不会引入Cl-,使制得的MnSO4H2O产品更纯净
(4)4.7≤a<7.6(5)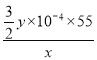
【解析】
试题分析:(1)向菱锰矿中加入过量稀H2SO4,只有SiO2不溶于硫酸,步骤Ⅰ中,滤渣的主要成分是SiO2;(2)根据电子守恒,电荷守恒,MnO2氧化Fe2+的离子方程式,MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;(3)氯气的还原产物是Cl-,与选用Cl2作为氧化剂相比,MnO2的优势主要在于:原料来源广、成本低、可避免环境污染、不会引入Cl-;(4)为除去溶液中的Al3+、Fe3+,而不让Mn2+沉淀,a的取值范围是4.7≤a<7.6;(5)根据反应方程式![]() ,消耗0.1mol/L KMnO4溶液y mL,则Mn2+的物质的量为
,消耗0.1mol/L KMnO4溶液y mL,则Mn2+的物质的量为![]() =1.5y
=1.5y![]() ;Mn2+的质量1.5y
;Mn2+的质量1.5y![]()
![]() ,锰元素的质量分数为
,锰元素的质量分数为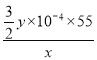 。
。

 名校课堂系列答案
名校课堂系列答案