题目内容
【题目】将足量CO2通入KOH和Ca(OH)2的混合溶液中,生成沉淀的质量(m)和通入CO2体积(V)的关系如图所示:
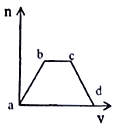
(1)ab段发生的离子反应方程式为_____________。
(2)bc段依次发生两个离子反应,首先是_________, 其次是___________。
(3)cd段发生的离子反应方程式是___________。
【答案】
(1)CO2+2OH-+Ca2+=CaCO3↓+H2O
(2)首先是CO2+2OH-=CO32-+ H2O,其次是CO2+CO32-+ H2O=2HCO3-
(3)CO2+H2O+CaCO3=Ca2++2HCO3-。
【解析】
试题分析:(1)一开始二氧化碳与氢氧化钙反应生成碳酸钙,此时沉淀质量增加,反应的方程式为CO2+2OH-+Ca2+=CaCO3↓+H2O,故答案为:CO2+2OH-+Ca2+=CaCO3↓+H2O;
(2)当二氧化碳和氢氧化钙反应完毕后,继续投入二氧化碳,二氧化碳与氢氧化钾的反应生成碳酸钾,如何继续与碳酸钾反应生成碳酸氢钾,离子反应方程式为CO2+2OH-=CO32-+ H2O,CO2+CO32-+ H2O=2HCO3-,故答案为:CO2+2OH-=CO32-+ H2O;CO2+CO32-+ H2O=2HCO3-;
(3)当把碳酸钾及氢氧化钾完全反应后,二氧化碳与碳酸钙反应生成了能够溶于水的碳酸氢钙,此时沉淀逐渐减少最后为零,反应的离子方程式为CO2+H2O+CaCO3=Ca2++2HCO3-,故答案为:CO2+H2O+CaCO3=Ca2++2HCO3-。

【题目】用菱锰矿(主要含MnCO3、FeCO3、Al2O3、SiO2)制备MnSO4·H2O的工艺流程如下:
Ⅰ.向菱锰矿中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量MnO2,过滤;
Ⅲ.调节滤液pH=a,过滤;
Ⅳ.浓缩、结晶、分离、干燥得到产品;
Ⅴ.检验产品纯度。
(1)步骤Ⅰ中,滤渣的主要成分是 。
(2)将MnO2氧化Fe2+的离子方程式补充完整:
MnO2 + ![]() Fe2+ +
Fe2+ +![]() =
=![]() Mn2+ +
Mn2+ + ![]() Fe3+ +
Fe3+ +![]()
(3)与选用Cl2作为氧化剂相比,MnO2的优势主要在于:原料来源广、成本低、可避免环境污染、 。
(4)已知:生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 | 7.6 |
完全沉淀时 | 4.7 | 8.3 | 2.8 | 10.2 |
注:金属离子的起始浓度为0.1mol/L
步骤Ⅲ中a的取值范围是 。
(5)步骤Ⅴ,通过测定产品中锰元素的质量分数来判断产品纯度。
已知一定条件下,MnO4-与Mn2+反应生成MnO2 。取x g产品配成溶液,用0.1mol/L KMnO4溶液滴定,消耗KMnO4溶液y mL,产品中锰元素的质量分数为 (用含x、y表示)
【题目】下列物质分类的正确组合是( )
选项 | 酸 | 碱 | 碱性氧化物 | 盐 |
A | H2CO3 | 纯碱 | CaO | 明矾 |
B | H2SO4 | 烧碱 | Na2O | 小苏打 |
C | HNO3 | 氨水 | Al2O3 | 石灰石 |
D | NaHCO3 | 熟石灰 | Al(OH)3 | 食盐 |
A.A
B.B
C.C
D.D
