题目内容
【题目】为了在实验室利用工业原料制备少量氨气,有人设计了如下装置(图中夹持装置均已略去)。
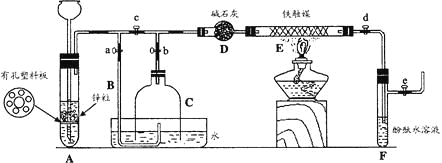
[实验操作]
① 检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗注入一定量稀硫酸。打开弹簧夹c、d、e,则A中有氢气发生。在F出口处收集氢气并检验其纯度。
② 关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③ 用酒精灯加热反应管E,继续通氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
回答下列问题:
(1)检验氢气纯度的目的是 。
(2)C瓶内水位下降到液面保持不变时,A装置内发生的现象是 ,防止了实验装置中压强过大。此时再打开弹簧夹b的原因是 ,C瓶内气体的成份是 。
(3)在步骤③中,先加热铁触媒的原因是 。反应管E中发生反应的化学方程式是 。
【答案】(1)“排除空气,保证安全”或“判断装置中空气是否排净,保证安全”(合理即可)
(2)锌粒与酸脱离;尽量增大氢气的浓度以提高氮气的转化率;N2;H2
(3)升高温度,增大铁触媒活性,加快氨的合成反应速率;N2+3H2![]() 2NH3
2NH3
【解析】试题分析:(1)氢气和空气混合气体受热易爆炸。若不检验氢气的纯度可能在E处发生危险。(2)A装置原理类似启普发生器当试管内压强过大酸会流回长颈漏斗中使反应停止。C瓶利用排水法收集氢气氢气收集满后再通入气体压强变大导致A中酸流回漏斗和锌粒脱离接触反应停止。C中原有空气里的氧气被氢气燃烧而消耗最终主要剩余氮气,所以C中气体主要成分为氮气和氢气。通氢气一直到压强增大到不能增大为止可以让通入的氢气尽可能多。根据化学平衡原理增大氢气浓度可以提高氮气的转化率。(3)铁触媒在较高温度时活性增大加快氨合成的反应速率。发生的反应为: N2+3H2![]() 2NH3。
2NH3。

 名校课堂系列答案
名校课堂系列答案【题目】用菱锰矿(主要含MnCO3、FeCO3、Al2O3、SiO2)制备MnSO4·H2O的工艺流程如下:
Ⅰ.向菱锰矿中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量MnO2,过滤;
Ⅲ.调节滤液pH=a,过滤;
Ⅳ.浓缩、结晶、分离、干燥得到产品;
Ⅴ.检验产品纯度。
(1)步骤Ⅰ中,滤渣的主要成分是 。
(2)将MnO2氧化Fe2+的离子方程式补充完整:
MnO2 + ![]() Fe2+ +
Fe2+ +![]() =
=![]() Mn2+ +
Mn2+ + ![]() Fe3+ +
Fe3+ +![]()
(3)与选用Cl2作为氧化剂相比,MnO2的优势主要在于:原料来源广、成本低、可避免环境污染、 。
(4)已知:生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 | 7.6 |
完全沉淀时 | 4.7 | 8.3 | 2.8 | 10.2 |
注:金属离子的起始浓度为0.1mol/L
步骤Ⅲ中a的取值范围是 。
(5)步骤Ⅴ,通过测定产品中锰元素的质量分数来判断产品纯度。
已知一定条件下,MnO4-与Mn2+反应生成MnO2 。取x g产品配成溶液,用0.1mol/L KMnO4溶液滴定,消耗KMnO4溶液y mL,产品中锰元素的质量分数为 (用含x、y表示)