��Ŀ����
(2014�콭��ʡ�ϲ��и���3�µ�һ��ģ�⿼�����ۻ�ѧ�Ծ���
�о�CO��SO2��NO�ȴ�����Ⱦ������ۺϴ��������þ�����Ҫ���塣
��1����CO��CO2��H2Ϊԭ�ϣ���һ�������¾��ɺϳɼ״�������Ϊ�����ֺϳ������·�����ϡ���ɫ��ѧ��������û�ѧ��Ӧ����ʽ��ʾ�� ��
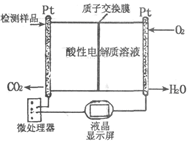
��2����ͼ��ʾ�����ںϳɼ״���Ʒ�м״������ļ���ǡ�д������������ʱ�ĵ缫��Ӧʽ��
���� ������ ��
��3��һ�������£�NO2��SO2��Ӧ����SO3��g����NO�������壬�ֽ������Ϊ1:2��NO2��SO2�Ļ�����������ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬���� ��������ţ�
���������ƽ����ϵ��NO2��SO2�����Ϊ1:6ʱ����÷�Ӧƽ�ⳣ��KֵΪ ��
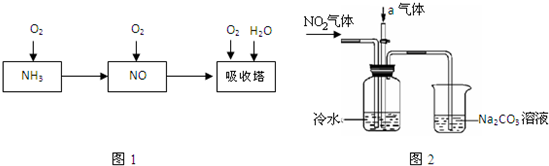
��4����ҵ����Na2CO3������Һ����NO��NO2���壺
NO+NO2+Na2CO3=2NaNO2+CO2 2NO2+Na2CO3=NaNO3+NaNO2+CO2
����������Na2CO3��Һ��ȫ����NO��NO2������壬ÿ������״����CO2 2��24L��CO2����ȫ���ݳ���ʱ������Һ����������4��4g������������NO��NO2�����Ϊ ��
�о�CO��SO2��NO�ȴ�����Ⱦ������ۺϴ��������þ�����Ҫ���塣
��1����CO��CO2��H2Ϊԭ�ϣ���һ�������¾��ɺϳɼ״�������Ϊ�����ֺϳ������·�����ϡ���ɫ��ѧ��������û�ѧ��Ӧ����ʽ��ʾ�� ��
��2����ͼ��ʾ�����ںϳɼ״���Ʒ�м״������ļ���ǡ�д������������ʱ�ĵ缫��Ӧʽ��

���� ������ ��
��3��һ�������£�NO2��SO2��Ӧ����SO3��g����NO�������壬�ֽ������Ϊ1:2��NO2��SO2�Ļ�����������ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬���� ��������ţ�
| A����ϵѹǿ���ֲ��� | B�����������ɫ���ֲ��� |
| C��SO3��NO������ȱ��ֲ��� | D��ÿ���� 1 mol SO2��ͬʱ����1 mol NO |
��4����ҵ����Na2CO3������Һ����NO��NO2���壺
NO+NO2+Na2CO3=2NaNO2+CO2 2NO2+Na2CO3=NaNO3+NaNO2+CO2
����������Na2CO3��Һ��ȫ����NO��NO2������壬ÿ������״����CO2 2��24L��CO2����ȫ���ݳ���ʱ������Һ����������4��4g������������NO��NO2�����Ϊ ��
��1��CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
��2��������2CH3OH-12e-+2H2O 2CO2+12H+ ������3O2+12e-+12H+ 6H2O
��3�� B 2��67(��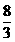 ) ��4��1��7
) ��4��1��7
 CH3OH(g)
CH3OH(g) ��2��������2CH3OH-12e-+2H2O 2CO2+12H+ ������3O2+12e-+12H+ 6H2O
��3�� B 2��67(��
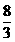 ) ��4��1��7
) ��4��1��7��1����Ϊ��ѧ��Ӧ�Ĺ��̾���ԭ��������ϵĹ��̣����ڡ���ɫ��ѧ�����Ƿ�Ӧ���ԭ����ȫת��ΪĿ�����������ʹ��CO��H2����ȡCH3OH ����Ӧ�ķ���ʽΪ��CO(g)+2H2(g)
 CH3OH(g)����2�����ͨ��״��ĵ缫Ϊ�������缫��ӦΪ��2CH3OH-12e-+2H2O=2CO2+12H+���ұ�ͨ��O2�ĵ缫Ϊ���������������Խ��ʣ������ĵ缫��ӦΪ��3O2+12e-+12H+=6H2O����3��NO2��SO2��Ӧ����SO3��g����NO�ķ���ʽΪ��NO2+SO2
CH3OH(g)����2�����ͨ��״��ĵ缫Ϊ�������缫��ӦΪ��2CH3OH-12e-+2H2O=2CO2+12H+���ұ�ͨ��O2�ĵ缫Ϊ���������������Խ��ʣ������ĵ缫��ӦΪ��3O2+12e-+12H+=6H2O����3��NO2��SO2��Ӧ����SO3��g����NO�ķ���ʽΪ��NO2+SO2 SO3(g)+NO��A���÷�Ӧ�Ƿ�Ӧǰ�����������ȵĿ��淴Ӧ���������۷�Ӧ�Ƿ�ﵽƽ�⣬��Ӧ��ѹǿ�����ᷢ���仯��B�������������ݻ����䣬����Ӧ�ﵽƽ�⣬�κ����ʵ����ʵ������䣬NO2����ɫ�����ʣ���Ũ�Ȳ��䣬���Ի��������ɫ���ֲ��䡣��˸÷�Ӧ�ﵽƽ�⡣��ȷ��C��������ӦNO2+SO2
SO3(g)+NO��A���÷�Ӧ�Ƿ�Ӧǰ�����������ȵĿ��淴Ӧ���������۷�Ӧ�Ƿ�ﵽƽ�⣬��Ӧ��ѹǿ�����ᷢ���仯��B�������������ݻ����䣬����Ӧ�ﵽƽ�⣬�κ����ʵ����ʵ������䣬NO2����ɫ�����ʣ���Ũ�Ȳ��䣬���Ի��������ɫ���ֲ��䡣��˸÷�Ӧ�ﵽƽ�⡣��ȷ��C��������ӦNO2+SO2 SO3(g)+NO ��ÿ����SO31mol,��Ȼͬʱ����NO1mol��������۷�Ӧ�Ƿ�ﵽƽ�⣬SO3��NO�������ʼ�ձ��ֲ��䡣�ʲ�����Ϊ��Ӧ�ﵽƽ��ı�־������D��SO2�Ƿ�Ӧ�NOΪ���������ʽ�ж��ߵ����ʵ����ı�Ϊ1:1,����ÿ���� 1 mol SO2��ͬʱ����1 mol NO ���뷴Ӧ�Ƿ�ﵽƽ���أ���˲�����Ϊ��Ӧ�ﵽƽ��ı�־�������跴Ӧ��ʼʱ��n(NO2)="amol;" n(SO2)=2amol�����ڷ�Ӧ������?n(NO2)="xmol" ����?n(SO2)=xmol,��ﵽƽ���Ƿ�ӦNO2+SO2
SO3(g)+NO ��ÿ����SO31mol,��Ȼͬʱ����NO1mol��������۷�Ӧ�Ƿ�ﵽƽ�⣬SO3��NO�������ʼ�ձ��ֲ��䡣�ʲ�����Ϊ��Ӧ�ﵽƽ��ı�־������D��SO2�Ƿ�Ӧ�NOΪ���������ʽ�ж��ߵ����ʵ����ı�Ϊ1:1,����ÿ���� 1 mol SO2��ͬʱ����1 mol NO ���뷴Ӧ�Ƿ�ﵽƽ���أ���˲�����Ϊ��Ӧ�ﵽƽ��ı�־�������跴Ӧ��ʼʱ��n(NO2)="amol;" n(SO2)=2amol�����ڷ�Ӧ������?n(NO2)="xmol" ����?n(SO2)=xmol,��ﵽƽ���Ƿ�ӦNO2+SO2 SO3(g)+NOƽ����ϵ��n(NO2)=(a-x)mol;n(SO2)=(2a-x)mol;n(SO3)=xmol;n(NO)=xmol������ƽ��ʱNO2��SO2�����Ϊ1:6������(a-x)��(2a-x)=1:6�����
SO3(g)+NOƽ����ϵ��n(NO2)=(a-x)mol;n(SO2)=(2a-x)mol;n(SO3)=xmol;n(NO)=xmol������ƽ��ʱNO2��SO2�����Ϊ1:6������(a-x)��(2a-x)=1:6�����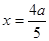 �������ڸ��¶��¸÷�Ӧƽ�ⳣ��
�������ڸ��¶��¸÷�Ӧƽ�ⳣ��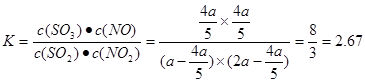 ����4���ɷ���ʽ���Կ�����ÿ����1mol��CO2�����Ļ������2mol�����ڲ���2��24L��־״���µ�CO2��������0��1 mol CO2��������������0��1mol�������������Ħ������Ϊ44g/mol������NOΪxmol, NO2Ϊ(1-x)mol��30x+46(1-x)=44����x:(1-x)=1:7��
����4���ɷ���ʽ���Կ�����ÿ����1mol��CO2�����Ļ������2mol�����ڲ���2��24L��־״���µ�CO2��������0��1 mol CO2��������������0��1mol�������������Ħ������Ϊ44g/mol������NOΪxmol, NO2Ϊ(1-x)mol��30x+46(1-x)=44����x:(1-x)=1:7��
��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ
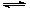 CH3OH��g��+ H2O��g�� ��H<0��CH3OH��Ũ����ʱ��仯��ͼ���ش��й����⣺
CH3OH��g��+ H2O��g�� ��H<0��CH3OH��Ũ����ʱ��仯��ͼ���ش��й����⣺
 Na2S4 + 3NaBr���øõ��Ϊ��Դ������������ˮ��Һ������ʽ��е�⣬ʹCO2��ͭ�缫�Ͽ�ת��Ϊ���顣
Na2S4 + 3NaBr���øõ��Ϊ��Դ������������ˮ��Һ������ʽ��е�⣬ʹCO2��ͭ�缫�Ͽ�ת��Ϊ���顣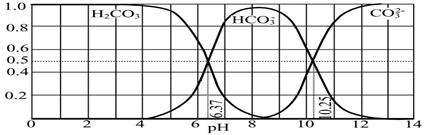
 N2O4��g����ƽ�ⳣ��K= ����NO2��ʼŨ��Ϊ2mol/L����ͬ�����£�NO2�����ת����Ϊ ��
N2O4��g����ƽ�ⳣ��K= ����NO2��ʼŨ��Ϊ2mol/L����ͬ�����£�NO2�����ת����Ϊ ��
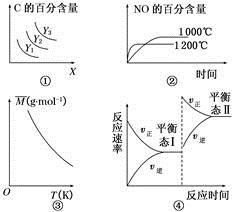
 3C(g)����H>0����ƽ��ʱC�İٷֺ���������X��Y�Ĺ�ϵ��ͼ����ʾ����Y���ܱ�ʾ�¶ȣ�X���ܱ�ʾѹǿ����Y3>Y2>Y1
3C(g)����H>0����ƽ��ʱC�İٷֺ���������X��Y�Ĺ�ϵ��ͼ����ʾ����Y���ܱ�ʾ�¶ȣ�X���ܱ�ʾѹǿ����Y3>Y2>Y1 4NO(g)��6H2O(g)����H����1 025 kJ��mol��1������Ӧ����ʼ���ʵ�����ͬ����ͼ�ڿɱ�ʾ�¶ȶ�NO�İٷֺ�����Ӱ��
4NO(g)��6H2O(g)����H����1 025 kJ��mol��1������Ӧ����ʼ���ʵ�����ͬ����ͼ�ڿɱ�ʾ�¶ȶ�NO�İٷֺ�����Ӱ�� 2NO(g)��O2(g)������̶����ܱ������з�Ӧ���ﵽƽ��״̬�ı�־�� (����)
2NO(g)��O2(g)������̶����ܱ������з�Ӧ���ﵽƽ��״̬�ı�־�� (����) 2SO3�������������Ҫ��Ӧ�����й��ڸ÷�Ӧ��˵����ȷ����
2SO3�������������Ҫ��Ӧ�����й��ڸ÷�Ӧ��˵����ȷ���� xC(g)+2D(g)����4min����D��Ũ��Ϊ0��5mol/L��c(A)��c(B)=3��5����C��ʾ��ƽ������v��C��=0��125mol��L-1��min-1������˵����ȷ����
xC(g)+2D(g)����4min����D��Ũ��Ϊ0��5mol/L��c(A)��c(B)=3��5����C��ʾ��ƽ������v��C��=0��125mol��L-1��min-1������˵����ȷ����