题目内容
(本题16分)降低大气中CO2的含量和有效地开发利用CO2正成为研究的主要课题。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)在容积为2L的密闭容器中,充入2mol CO2和6mol H2,在温度500℃时发生反应:
CO2(g)+ 3H2(g)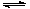 CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图。回答有关问题:
CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图。回答有关问题:
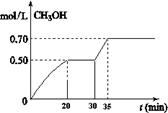
①从反应开始到20分钟时,H2的平均反应速率v(H2)=_________________。
②从30分钟到35分钟达到新的平衡,改变的条件可能是 。
A. 增大压强 B.加入催化剂 C.升高温度 D.增大反应物的浓度
③列式计算该反应在35分钟达到新平衡时的平衡常数(保留2位小数)
④如果在30分钟时,再向容器中充入2mol CO2和6mol H2,保持温度不变,达到新平衡时,CH3OH的浓度____________1mol.L-1(填“>”、“<”或“=”)。
(3)一种原电池的工作原理为:2Na2S2 + NaBr3 Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
①该电池负极的电极反应式为: 。
②电解池中产生CH4一极的电极反应式为: 。
(4)下图是NaOH吸收CO2后某种产物的水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数。
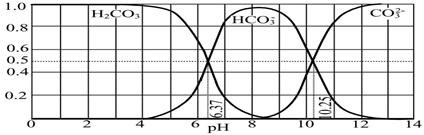
下列叙述正确的是 。
A.此图是1.0 mol·L-1碳酸钠溶液滴定1.0 mol·L-1 HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)在容积为2L的密闭容器中,充入2mol CO2和6mol H2,在温度500℃时发生反应:
CO2(g)+ 3H2(g)
 CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图。回答有关问题:
CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图。回答有关问题:
①从反应开始到20分钟时,H2的平均反应速率v(H2)=_________________。
②从30分钟到35分钟达到新的平衡,改变的条件可能是 。
A. 增大压强 B.加入催化剂 C.升高温度 D.增大反应物的浓度
③列式计算该反应在35分钟达到新平衡时的平衡常数(保留2位小数)
④如果在30分钟时,再向容器中充入2mol CO2和6mol H2,保持温度不变,达到新平衡时,CH3OH的浓度____________1mol.L-1(填“>”、“<”或“=”)。
(3)一种原电池的工作原理为:2Na2S2 + NaBr3
 Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。①该电池负极的电极反应式为: 。
②电解池中产生CH4一极的电极反应式为: 。
(4)下图是NaOH吸收CO2后某种产物的水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数。

下列叙述正确的是 。
A.此图是1.0 mol·L-1碳酸钠溶液滴定1.0 mol·L-1 HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间
31.答案(16分)
(1)CH3OH(l)+ O2(g) = CO(g) + 2H2O(l) ΔH=﹣442.8 kJ∕mol (2分)
(2)①0.15 mol/(L·min) (2分)
②D (2分) ③0.15 mol-2.L2(2分) ④> (2分)
(3)①2S22- - 2e-=S42- (2分) ②CO2+8e-+6H2O=CH4+8OH-(2分)
(4)CD (2分)
(1)CH3OH(l)+ O2(g) = CO(g) + 2H2O(l) ΔH=﹣442.8 kJ∕mol (2分)
(2)①0.15 mol/(L·min) (2分)
②D (2分) ③0.15 mol-2.L2(2分) ④> (2分)
(3)①2S22- - 2e-=S42- (2分) ②CO2+8e-+6H2O=CH4+8OH-(2分)
(4)CD (2分)
试题分析: (1)根据已知方程式和盖斯定律可得,甲醇不完全燃烧的化学方程式=(①-②+4×③)/2,所以方程式为CH3OH(l)+ O2(g) = CO(g) + 2H2O(l) ΔH=﹣442.8 kJ∕mol。
(2)①v(H2)=3 v(CH3OH)=0.075 mol/(L·min)
②从30分钟到35分钟的过程中,甲醇的浓度瞬间没有增大,而是逐渐增大,所以该时刻改变的条件不可能是增大压强;由于加催化剂不能改变甲醇的浓度,所一不可能是加入了催化剂;升高温度平衡左移,甲醇浓度减小,所以C错误;故只能是增大了反应物的浓度,使平衡逐渐右移,甲醇浓度逐渐增大,达到新的平衡,故选D。
③因为在35分钟时改变的条件是增大了反应物浓度,所以没有改变温度,所以达到新平衡时的平衡常数与原平衡常数相等,因此有: CO2(g)+ 3H2(g)
 CH3OH(g)+ H2O(g)
CH3OH(g)+ H2O(g)初始浓度(mol/L): 1 3 0 0
转化浓度(mol/L): 0.5 1.5 0.5 0.5
平衡浓度(mol/L): 0.5 1.5 0.5 0.5
所以平衡常数K=c(CH3OH) c(H2O)/ c(CO2) c3(H2)=" 0.5×" 0.5 / 0.5× 1.53 ≈0.15 mol-2.L2 .
④在30min再充入等量的反应物,相当于增大了压强,平衡要正向移动,所以达到新平衡后甲醇的浓度比原来平衡时甲醇浓度的2倍还大,因此CH3OH的浓度大于1mol.L-1 。
(3)①从所给的原电池反应式可以看出S的化合价升高,所以Na2S2 做氧化剂在负极失去电子被还原,所以反应式为2S22- - 2e-=S42- 。
②电解池中由CO2生成CH4,可以看出生成甲烷的电极是阴极,发生还原反应,由于是碱性环境,所以式子中少O的一端生成OH-,所以电极反应式为:CO2+8e-+6H2O=CH4+8OH- 。
(4)由图象可以看出,开始H2CO3浓度最大,CO32-浓度最小,图象为在碳酸中逐滴滴加氢氧化钠溶液的图象,故A错误; pH为6.37时,c(H2CO3)=c(HCO3-),pH=10.25时,c(HCO3-)=c(CO32-),但三者的浓度不相等,故B错误; pH为7.4时,HCO3-的最大,则当人体血液的pH约为7.4,则CO2在血液中多以HCO3-的形式存在,故C正确;溶液的pH为7~9之间时,溶液中的阴离子主要以HCO3-形式存在,所以溶液中的溶质主要为碳酸氢钠,故D正确;因此选CD。

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案
相关题目
 2PbCrO4(s)+2H+(aq)△H<0
2PbCrO4(s)+2H+(aq)△H<0
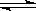 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )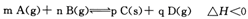 一段时间后达到化学平衡状态。改变某一条件,下列说法正确的是
一段时间后达到化学平衡状态。改变某一条件,下列说法正确的是 2AB(g)达到平衡的标志是 ( )
2AB(g)达到平衡的标志是 ( ) N2O3 + O2,N2O3又可按下列分解: N2O3
N2O3 + O2,N2O3又可按下列分解: N2O3