题目内容
【题目】聚苯乙烯塑料在生产中有广泛应用。工业中以乙苯(![]() )为原料制取装乙烯(
)为原料制取装乙烯(![]() )的主要途径有
)的主要途径有
①催化脱氢
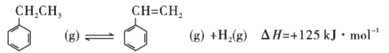
②氧化脱氢
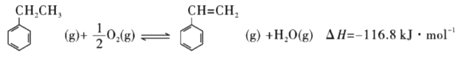
③和二氧化碳催化脱氢
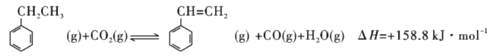
(1)苯乙烯在一定条件下合成聚苯乙烯的化学方程式为___________。
(2)根据上述信息,能否计算出CO的燃烧热?若不能计算,该空不用作答;若能计算,请写岀CO的燃烧热△H为___________。
(3)某企业以反应①生产苯乙烯。某同学认为:向反应体系①中通入适量的O2,能增加乙苯的转化率,该同学作出判断的依据可能是___________。
(4)在温度为T时,在2L的密闭容器中加入2mol乙苯和2mol二氧化碳,反应到平衡时测得混合物各组成的物质的量均为1.0mol。
①若保持温度和容器容积不变,向该容器中再充入2mol乙苯和2mol二氧化碳达到平衡时,则乙苯的物质的量浓度___________。
A.等于1mol·L-1 B.小于1mol·L-1 C.大于1mol·L-1 D.不确定
②若将反应改为恒压绝热条件下进行,达到平衡时,则乙苯的物质的量浓度___________。
A.等于0.5mol·L-1 B.小于0.5mol·L-1 C.大于0.5mol·L-1 D.不确定
(5)温度为T时,在恒容容器中进行上述“①催化脱氢”反应。已知:乙苯的起始浓度为1.0mol·L-1;设起始时总压强为a,平衡时总压强为b,达到平衡时需要的时间为tmin则从反应开始到平衡的过程中苯乙烯的平均反应速率为___________(用代数式表示,下同);该温度下的化学平衡常数为___________。
【答案】 -275.6kJ.mol-1 因为在高温下,O2会将反应中生成的H2消耗掉,减小了H2的浓度,同时反应放出的热量使休系温度升高,这两种因素均使平衡向正反应方向移动 C D
-275.6kJ.mol-1 因为在高温下,O2会将反应中生成的H2消耗掉,减小了H2的浓度,同时反应放出的热量使休系温度升高,这两种因素均使平衡向正反应方向移动 C D ![]() mol
mol![]() L-1 . min-1 (b-a)2/a(2a-b)mol·L-1
L-1 . min-1 (b-a)2/a(2a-b)mol·L-1
【解析】
(2)根据盖斯定律计算;(3)依据外界条件对平衡状态的影响分析。(4)①同等比例的增大反应物的量.相当于增大压强,对正反应气体分子数目增大的反应而言,乙苯的转化率减小,即再一次平衡时乙苯的物质的量大于2mol;②上述恒容容器中进行反应,气体压强增大,要将该反应在恒压条件下进行,相当于恒容条件下平衡状态减压达到新平衡,在平衡之后减压,平衡向正方向移动(正方向是气体分子数增大的方向),乙苯的物质的量浓度减小;又由于正反应是吸热反应,在绝热容器中,与外界没有能量交换,平衡向正方向移动,吸收热量会增多,容器内反应体系的温度会降低,平衡会向左移动,乙苯的浓度减小。二者使平衡移动方向不同且移动程度不确定,最终乙苯的浓度增大、减小或不变都有可能。
(1)苯乙烯在一定条件下合成聚苯乙烯的化学方程式为 。
。
(2)根据盖斯定律,②减去③可得:CO(g)+1/2O2(g)=CO2 (g)△H =-275.6kJ.mol-1 ,所以CO的燃烧热△H为-275.6kJ.mol-1;
(3)根据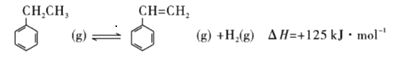 可知在高温下,通入O2会将反应中生成的H2消耗掉,减小了H2的浓度,同时氢气和氧气反应放出的热量使休系温度升高,这两种因素均使平衡向正反应方向移动。答案:通入O2会将反应中生成的H2消耗掉,减小了H2的浓度,同时氢气和氧气反应放出的热量使休系温度升高,这两种因素均使平衡向正反应方向移动。
可知在高温下,通入O2会将反应中生成的H2消耗掉,减小了H2的浓度,同时氢气和氧气反应放出的热量使休系温度升高,这两种因素均使平衡向正反应方向移动。答案:通入O2会将反应中生成的H2消耗掉,减小了H2的浓度,同时氢气和氧气反应放出的热量使休系温度升高,这两种因素均使平衡向正反应方向移动。
(4)①由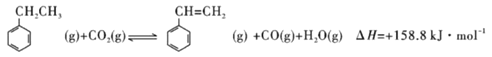 ,在温度为T时,在2L的密闭容器中加入2mol乙苯和2mol二氧化碳,反应到平衡时测得混合物各组成的物质的量均为1.0mol。同等比例的增大反应物的量.相当于增大压强,对正反应气体分子数目增大的反应而言,乙苯的转化率减小,即再一次平衡时乙苯的物质的量大于2mol, 乙苯的物质的量浓度大于1mol/L;故选C;
,在温度为T时,在2L的密闭容器中加入2mol乙苯和2mol二氧化碳,反应到平衡时测得混合物各组成的物质的量均为1.0mol。同等比例的增大反应物的量.相当于增大压强,对正反应气体分子数目增大的反应而言,乙苯的转化率减小,即再一次平衡时乙苯的物质的量大于2mol, 乙苯的物质的量浓度大于1mol/L;故选C;
②上述恒容容器中进行反应,气体压强增大,要将该反应在恒压条件下进行,相当于恒容条件下平衡状态减压达到新平衡,在平衡之后减压,平衡向正方向移动(正方向是气体分子数增大的方向),乙苯的物质的量浓度减小;又由于正反应是吸热反应,在绝热容器中,与外界没有能量交换,平衡向正向移动,吸收热量会增多,容器内反应体系的温度会降低,平衡会又会向左移动,乙苯的浓度减小。二者使平衡移动方向不同且移动程度不确定,最终乙苯的浓度增大、减小或不变都有可能。故答案为:D。
(5)根据三段式: 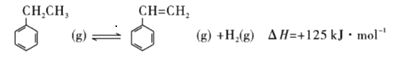
起始量(mol·L-1):1 0 0
变化量(mol·L-1) x x x
平衡量(mol·L-1)1-x x x
在相同温度相同体积的条件下,气体压强与物质的量成正比,则有;![]() ,x=
,x=![]() , 苯乙烯的平均反应速率为v=
, 苯乙烯的平均反应速率为v=![]() =
=![]() mol
mol![]() L-1·min-1;该温度下的化学平衡常数为K=
L-1·min-1;该温度下的化学平衡常数为K=![]() =(
=(![]() )2/
)2/![]() )=(b-a)2/a(2a-b).答案:
)=(b-a)2/a(2a-b).答案:![]() mol
mol![]() L-1 . min-1;(b-a)2/a(2a-b)。
L-1 . min-1;(b-a)2/a(2a-b)。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案