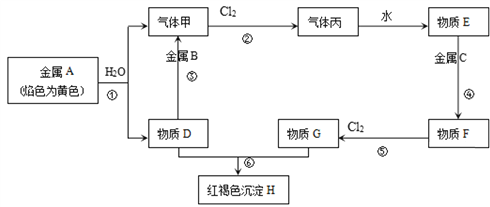
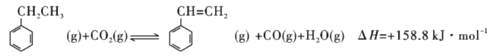题目内容
【题目】金属氟化物一般都具有高容量、高质量密度的特点。氟离子热电池是新型电池中的一匹黑马,其结构如图所示。下列说法正确的是

A. 图示中与电子流向对应的氟离子移动方向是(B)
B. 电池放电过程中,若转移1mol电子,则M电极质量减小12g
C. 电池充电过程中阳极的电极反应式为:B+3F--3e-=BiF3
D. 该电池需要在高温条件下工作,目的是将热能转化为电能
【答案】C
【解析】
A.根据电子流向可知M为原电池的正极,N为原电池的负极,阴离子由正极移向负极,由图可知氟离子移动方向是(A),故A错误;B。根据负极反应:Mg-2e-= Mg2+,电池放电过程中,若转移1mol电子,则N电极质量减小12g,故B错误;C. 电池充电过程中阳极的电极反应式为:Bi+3F--3e-=BiF3,故C正确;D. 该电池需要在高温条件下工作,目的是将化学能转化为电能,故D错误;答案:C。

练习册系列答案
相关题目