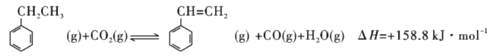题目内容
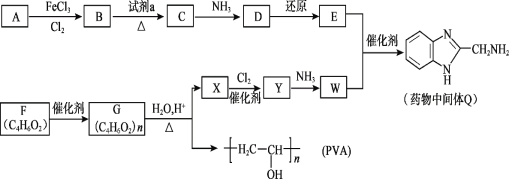
【题目】(1)有机物结构如图所示,用系统命名法命名,名称是_____;该烃的一氯代物有_____种。
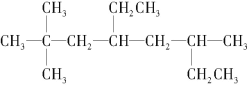
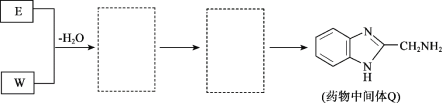
(2)有机物结构如图所示,用系统命名法命名,名称是_____,将其在催化剂存在下完全氢化,所得烷烃用系统命名法命名,名称是_____。
![]()
(3)现有 CH4、C2H4、C3H4、C2H6、C3H6 五种有机物。同质量的以上物质中,在相同状况下体积最大的是_____;同质量的以上物质完全燃烧时消耗 O2 的量最多的是_____;同质量的以上物质燃烧时,生成 H2O 的量最多的是_____;同状况、同体积的以上物质完全燃烧时消耗 O2 的量最多的是_____。
【答案】2,2,6-三甲基-4-乙基辛烷 10 3-甲基-1-丁烯 2-甲基丁烷 CH4 CH4 CH4 C3H6
【解析】
(1)系统命名法对有机物命名时,首先要确定主链。命名烷烃时,确定主链的原则是:首先考虑链的长短,长的优先。其次要根据最低系列原则对主链进行编号。最低系列原则的内容是:使取代基的号码尽可能小,若有多个取代基,逐个比较,直至比出高低为止。最后,根据有机化合物名称的基本格式写出全名,利用等效氢法分析烷烃的一氯代物种类数;
(2)烯烃的系统命名法是选择含碳碳双键的最长碳链作为主链,根据主链上所含碳的数目称为某烯,然后从碳链上靠近双键的一端开始进行编号,将双键上的第一个碳原子的号码加在烯烃名称的前面以表示双键位置,取代基的名称和位置的表示方法与烷烃相同.
(3)根据n=m/M可知,烃(CxHy)在质量相同情况下,摩尔质量越小,物质的量越大,相同条件下,体积之比等于物质的量之比;氢元素质量分数越大,消耗氧气越多;H元素质量分数越大,生成水的量越多;根据烷烃燃烧的通式CxHy+( x+y/4)O2![]() xCO2+
xCO2+![]() H2O,可知同状况同体积时,气体的物质的量相等,1mol烃的耗氧量为(x+y/4)mol,据此计算判断。
H2O,可知同状况同体积时,气体的物质的量相等,1mol烃的耗氧量为(x+y/4)mol,据此计算判断。
(1)根据系统命名法,首先要确定最长的碳链为主链,然后采取最低系列原则对主链进行编号如图所示: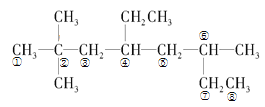 ,则该烷烃名称为:2,2,6-三甲基-4-乙基辛烷,根据等效氢法可知,该分子内
,则该烷烃名称为:2,2,6-三甲基-4-乙基辛烷,根据等效氢法可知,该分子内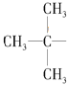 结构的中心碳原子周围的三个甲基上的氢原子等效,同一个碳原子上的氢原子等效,故种类为:10,
结构的中心碳原子周围的三个甲基上的氢原子等效,同一个碳原子上的氢原子等效,故种类为:10,
故答案为:2,2,6-三甲基-4-乙基辛烷;10;
(2)根据结构式![]() ,可看出含碳碳双键在内的最长链为主链,编号如下:
,可看出含碳碳双键在内的最长链为主链,编号如下: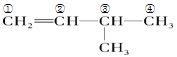 ,则该有机物名称为:3-甲基-1-丁烯,将其在催化剂存在下完全氢化,所得烷烃为
,则该有机物名称为:3-甲基-1-丁烯,将其在催化剂存在下完全氢化,所得烷烃为![]() ,则用系统命名法命名为2-甲基丁烷,
,则用系统命名法命名为2-甲基丁烷,
故答案为:3-甲基-1-丁烯;2-甲基丁烷;
(3)CH4、C2H4、C3H4、C2H6、C3H6 五种有机物均为气体,根据阿伏加德罗定律的推论可知,在相同状况下,体积之比等于物质的量之比,同质量的上述五种有机物分子,根据公式n = ![]() 可知,摩尔质量越小,其物质的量越大,体积越大。不难看出,CH4的摩尔质量最小,故体积最大的是CH4;相同质量情况下,氢元素质量分数越大,消耗氧气越多,CH4、C2H4、C3H4、C2H6、C3H6 五种有机物分子中C、H原子数目之比分别为:1:4、1:2、3:4、1:3、1:2,故CH4中氢元素质量分数最大,消耗氧气最多;相同质量时,H元素质量分数越大,生成水的量越多,CH4、C2H4,C3H4、C2H6、C3H6分子中C、H原子数目之比分别为:1:4、1:2、3:4、1:3、1:2,甲烷中氢元素质量分数最大,故甲烷生成水最多;同状况、同体积时,气体的物质的量相等,1 mol烃的耗氧量为(x+y/4) mol,1 mol CH4、C2H4、C2H6、C3H4、C3H6耗氧量分别为2 mol、3 mol、3.5 mol、4 mol、4.5 mol,故C3H6耗氧量最多,
可知,摩尔质量越小,其物质的量越大,体积越大。不难看出,CH4的摩尔质量最小,故体积最大的是CH4;相同质量情况下,氢元素质量分数越大,消耗氧气越多,CH4、C2H4、C3H4、C2H6、C3H6 五种有机物分子中C、H原子数目之比分别为:1:4、1:2、3:4、1:3、1:2,故CH4中氢元素质量分数最大,消耗氧气最多;相同质量时,H元素质量分数越大,生成水的量越多,CH4、C2H4,C3H4、C2H6、C3H6分子中C、H原子数目之比分别为:1:4、1:2、3:4、1:3、1:2,甲烷中氢元素质量分数最大,故甲烷生成水最多;同状况、同体积时,气体的物质的量相等,1 mol烃的耗氧量为(x+y/4) mol,1 mol CH4、C2H4、C2H6、C3H4、C3H6耗氧量分别为2 mol、3 mol、3.5 mol、4 mol、4.5 mol,故C3H6耗氧量最多,
故答案为:CH4;CH4;CH4;C3H6。