题目内容
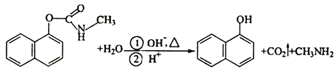
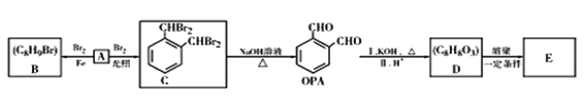
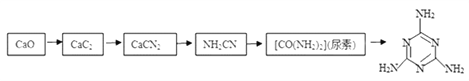
【题目】三聚氰胺俗称“蛋白精”,工业上通过下列流程合成三聚氰胺。请回答下列问题:
(1)基态Ca原子的电子排布式:___________________;CaC2的电子式__________。
(2)尿素分子中所含除氢以外元素第一电离能由小到大的顺序为________________。
(3)CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O和________(填化学式),由此可以推知CN22-的空间构型为__________________。
(4)三聚氰胺分子中碳原子的杂化方式为_____,分子中处于同一平面的氮原子有______个。
(5)动物摄入三聚氰胺和三聚氰酸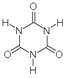 后,三聚氰酸与三聚氰胺分子相互之间通过________ 结合,在肾脏内易形成结石。
后,三聚氰酸与三聚氰胺分子相互之间通过________ 结合,在肾脏内易形成结石。
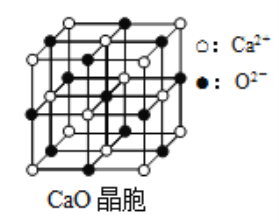
(6)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为______________,已知CaO晶体的密度ρ,用NA表示阿伏伽德罗常数,求晶胞中距离最近的两个钙离子之间的距离______________(用含ρ、NA代数式表示)。
【答案】 1s22s22p63s23p64s2或[Ar] 4s2 ![]() C O N CO2 直线形 sp2 3 分子间氢键 6
C O N CO2 直线形 sp2 3 分子间氢键 6 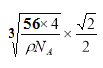
【解析】试题分析:(1)根据核外电子排布规律书写;碳化钙是离子化合物,据此书写电子式。
(2)根据影响第一电离能的因素分析。
(3)根据等电子体的含义分析;互为等电子体的空间构型相同;
(4)根据三聚氰胺的结构简式判断杂化方式和共面的原子;
(5)根据氮原子容易形成氢键分析;
(6)依据晶胞结构,借助于均摊法分析、判断和进行有关计算。
解析:(1)钙的原子序数是20,其基态原子的电子排布式是1s22s22p63s23p64s2或[Ar] 4s2;碳化钙是离子化合物,电子式为![]() 。
。
(2)氮元素的2p轨道电子处于半充满状态,稳定性强,其第一电离能大于氧元素,则第一电离能大小顺序是C<O<N。
(3)原子数和价电子数分别都相等的是等电子体,则与CN22-互为等电子体的分子有N2O和CO2,CO2是直线形结构,由此可以推知CN22-的空间构型为直线形;
(4)在三聚氰胺中碳形成4个共价键,属于sp3杂化;在三聚氰胺中,氨基中的N原子为sp3杂化,为三角锥构型;N、H原子不会在同一平面上,所以分子中处于同一平面的氮原子有3个;
(5)由于N原子半径小,元素的非金属性强,分子内容易形成氢键,在肾脏内易形成结石。
(6)根据CaO的结构可知,在晶胞中每个Ca2+周围有6个O2-,配位数是6;在CaO晶体的一个晶胞中含有Ca2+:8×1/8+6×1/2=4,含有O2-:12×1/4+1=4。即一个晶胞中含有4个CaO。晶胞中最近的两个Ca2+的距离为在晶胞面对角线的一半。假设晶胞的边长为a,则![]() ,所以
,所以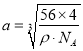 ,则晶胞中最近的两个Ca2+的距离为L=
,则晶胞中最近的两个Ca2+的距离为L=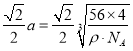 。
。