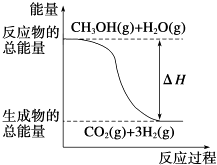
��Ŀ����
����Ŀ��һ��������������Ʒ�Ӧ�����Ʊ��������ƣ���Ӧ����ʽΪ��2NO+Na2O2��2NaNO2��һ����������ľ̿��Ũ���ᡢˮ��ͭΪԭ���Ʊ���ʵ��װ��ͼ��ͼ��ʾ�����ּг�װ���ԣ���



��֪�������£���3NaNO2+3HCl��3NaCl+HNO3+2NO��+H2O��
�����������£�NO��NO2�C������MnO4�C��Ӧ����NO3�C��Mn2+
���������գ�
��1������a������_________��
��2��д��Ũ������ľ̿��Ӧ�Ļ�ѧ����ʽ___________________________________��
��3��B�й۲쵽����Ҫ������_____________________________________________��
��4��Dװ�õ�������______________________________��D�з�����Ӧ�����ӷ���ʽ____________��
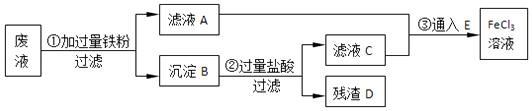
��5��������C�����г�������������и�����̼���ƺ�______��Ϊ���������Щ������Ӧ��B��Cװ�ü�����װ��_______�����롰E����F����
���𰸡� ������ƿ C+4HNO3(Ũ)![]() CO2��+4NO2��+2H2O ͭƬ���ܽ⣬��Һ��Ϊ��ɫ������ɫ��������ɫ���� β�����ճ�ȥδ��Ӧ��NO��ֹ��Ⱦ���� 5NO��3MnO4����4H��=5NO3����3Mn2����2H2O NaOH F
CO2��+4NO2��+2H2O ͭƬ���ܽ⣬��Һ��Ϊ��ɫ������ɫ��������ɫ���� β�����ճ�ȥδ��Ӧ��NO��ֹ��Ⱦ���� 5NO��3MnO4����4H��=5NO3����3Mn2����2H2O NaOH F
����������1������a������Ϊ����ƿ��������ƿ��
��2��Ũ������ľ̿�����·�Ӧ�Ļ�ѧ����ʽΪ��C+4HNO3(Ũ)![]() CO2��+4NO2��+2H2O��
CO2��+4NO2��+2H2O��
��3��A�з�Ӧ���ɵ�NO2��B����Һ����ˮ���ã����������NO�����Ὣ����ͭ�ܽ�Ϊ����ͭ�����ɵ�NO�տ�ʼ��Ӵ���Һ�Ϸ��Ŀ�����Ϊ����ɫ��Ȼ����Ϊ������������ȫ�������ֱ�Ϊ��ɫ��
��4��D�и��������Һ�������dz�ȥδ��Ӧ��NO����ֹ��Ⱦ������������Ŀ��֪�ڵõ���������ؽ�NO����Ϊ��������ӣ���������ԭΪMn2+�����ݻ��ϼ�������Ⱥ�ԭ�Ӹ����غ�������غ�õ����ӷ���ʽΪ��5NO��3MnO4����4H����5NO3����3Mn2����2H2O��
��5����B�еõ���������һ����A�����ɵĶ�����̼�Լ�B�д�������ˮ�������������������������Ʒ�Ӧ���õ�̼���ƺ��������ƣ�Ϊ�˱����������ʣ�Ӧ����B��C֮�����F������F�еļ�ʯ�����ն�����̼��ˮ������