题目内容
【题目】阿伏加德罗曾做过这样一个实验:“一个抽空的密闭容器重Mg,在标准状况下,盛满相同物质的量的NO和H2的混合气体后,称量为(M+Q)g。把混合气体排尽,再充满SO2气体,为使天平平衡,应在托盘天平的 边托盘上放置 g砝码。”横线上分别应填的是 ( )
A.右 (M+2Q)
B.右 (M+4Q)
C.左 (M+2Q)
D.左 (M+4Q)
【答案】B
【解析】
同一容器在同一条件下盛放不同的气体时,所含分子数必然相等,NO和H2按相同物质的量混合时,气体的平均相对分子质量为![]() =16,而SO2的相对分子质量为64,称量物品质量时,砝码应放在天平的右盘,设密闭容器内气体的物质的量为n,则盛满以相同物质的量混合的NO和H2的混合气体后,气体的质量为16n=Q,n=
=16,而SO2的相对分子质量为64,称量物品质量时,砝码应放在天平的右盘,设密闭容器内气体的物质的量为n,则盛满以相同物质的量混合的NO和H2的混合气体后,气体的质量为16n=Q,n=![]() ,当充满SO2气体时,气体的质量为:m=64n=64×
,当充满SO2气体时,气体的质量为:m=64n=64×![]() =4Q,容器的总质量为M+4Q,
=4Q,容器的总质量为M+4Q,
答案选B。

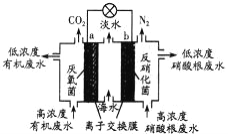
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:______________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是________________________
(3)吸收液吸收SO2的过程中,pH随n(SO3﹣):n(HSO3﹣)变化关系如下表:
n(SO﹣):n(HSO﹣) | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显______性,用化学平衡原理解释:____________
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):____________
a.c(Na+)=2c(SO32-)+c(HSO3-),
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
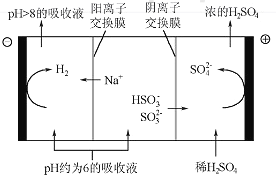
①HSO3-在阳极放电的电极反应式是_______________。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:__________
【题目】I、“蓝天白云”是现代城市人向往的目标,而机动车尾气已成为城市大气的主要污染源,机动车尾气中的主要有害物质为氮的氧化物目前科技工作者正在探索用甲烷等燃料气体将氮氧化物还原为N2和水,涉及到的反应有:
CH4(g)+4NO2(g) =4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+2NO2(g) =CO2(g)+2H2O(g)+N2(g) ΔH2=-867 kJ·mol-1
写出CH4还原NO生成N2的热化学方程式: ____________
Ⅱ、一定温度下,在三个体积均为2.0L的恒容密闭容器中分别加入一定量的X发生反应:
pX(g)Y(g)+Z(g)相关数据如下表所示:
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
X(g) | Y(g) | Z(g) | ||
A | 387 | 0.20 | 0.080 | 0.080 |
B | 387 | 0.40 | 0.160 | 0.160 |
C | T | 0.20 | 0.090 | 0.090 |
回答下列问题:
(1)若容器A中反应经10min达到平衡,则前10min内Y的平均反应速率v(Y)=___________。容器A和容器B中起始时X的反应速率v(X)A___________v(X)B(填“大于”“小于”或“等于”)。
(2)已知该正反应为放热反应,则T___________387(填“大于”或“小于”)。
(3)容器B中X的平衡转化率为___________,若起始时向容器A中充入0.1molX、0.15molY和0.10molZ,则反应将向___________(填“正”或“逆”)反应方向进行,判断理由是_____________________________________________________
Ⅲ、科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置实现了用CO2和H2O合成CH4下列关于该太电池的叙述错误的是____________
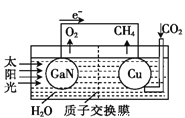
A.电池工作时,是将太阳能转化为电能
B.铜电极为正极,电极反应式为:CO2+8e-+8H+=CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
D.为提高该人工光合系统的工作效率,可向装置中加入少量硝酸溶液