题目内容
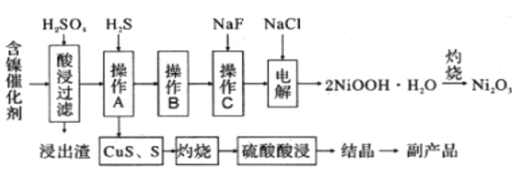
【题目】为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺。工艺流程如图:
已知:①常温下,有关氢氧化物开始沉淀和沉淀完全的pH如表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.7 | 9.7 | 9.2 |
②常温下,Ksp(CaF2)= 2.7×10-11
回答下列问题:
(1)加快酸浸速率的常用措施有_____________(任写一条)。
(2)写出酸浸时Fe2O3和硫酸反应的离子方程式________________________________。
(3)浸出渣主要成分为CaSO4·2H2O和______________两种物质。
(4)操作B的过程是先在40~50℃加入H2O2,其作用是___________________________(用离子方程式表示);再调节PH至3.7~7.7,操作B可除去溶液中的______元素(填元素名称)。
(5)操作C可除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol/L,则溶液中c(Ca2+):c(F-) =___________________。
(6)在碱性条件下,电解产生2NiOOH·H2O的原理分两步:
① Cl- 在阳极被氧化为ClO-,则阳极的电极反应为_____________________。
② Ni2+ 被ClO-氧化产生2NiOOH·H2O沉淀,则该步反应的离子方程式为______________。
【答案】适当加热或搅拌或适当增大浓度(其他合理答案也可) Fe2O3+6H+=2Fe3+ +3H2O BaSO4 2Fe2++2H++H2O2=2Fe3++2H2O 铁 1.0×10-3 Cl-+2OH-﹣2e-=ClO-+H2O ClO-+2Ni2++4OH-=2NiOOHH2O↓+Cl-
【解析】
废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),用硫酸浸取,过滤得含有镍离子、铁离子、钙离子、铜离子的溶液,再通入硫化氢除去铜离子,且使铁离子被还原成亚铁离子,得硫化铜、硫固体,过滤得滤液中含有镍离子、亚铁离子、钙离子,加入氟化钠除去钙离子,再加入氯化钠后电解得NiOOH,灼烧得三氧化二镍,硫化铜、硫固体灼烧后用硫酸酸浸得硫酸铜溶液,结晶可得硫酸铜晶体,以此解答该题。
(1)加快酸浸速率,可适当加热或搅拌或适当增大浓度,故答案为:适当加热或搅拌或适当增大浓度;
(2)Fe2O3和硫酸反应生成盐和水,反应方程式为:Fe2O3+6H+=2Fe3+ +3H2O,故答案为:Fe2O3+6H+=2Fe3+ +3H2O;
(3)氧化钙和氧化钡与硫酸反应生成难溶的硫酸钙和硫酸钡,所以浸出渣主要成分为CaSO42H2O和BaSO4,故答案为:BaSO4;
(4)过氧化氢具有强氧化性,酸性条件下生成铁离子,易生成氢氧化铁沉淀而除去,反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O,故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;铁;
(5)根据常温时CaF2的溶度积常数为2.7×1011可知,溶液中F浓度为3×103molL1,则Ca2+的浓度为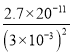 =3×106mol/L,所以则溶液中
=3×106mol/L,所以则溶液中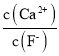 =
=![]() =1.0×103,故答案为:1.0×103;
=1.0×103,故答案为:1.0×103;
(6)①阳极上氯离子失电子生成氯气,氯气和氢氧根离子反应生成次氯酸根离子和水,所以阳极反应式为Cl+2OH2e═ClO+H2O,故答案为:Cl+2OH2e═ClO+H2O;
②Ni2+被ClO氧化产生2NiOOHH2O沉淀,其还原产物是氯离子,则根据电子的得失守恒可知,反应的离子方程式为ClO-+2Ni2++4OH-=2NiOOHH2O↓+Cl-,故答案为:ClO-+2Ni2++4OH-=2NiOOHH2O↓+Cl-。

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:______________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是________________________
(3)吸收液吸收SO2的过程中,pH随n(SO3﹣):n(HSO3﹣)变化关系如下表:
n(SO﹣):n(HSO﹣) | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显______性,用化学平衡原理解释:____________
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):____________
a.c(Na+)=2c(SO32-)+c(HSO3-),
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
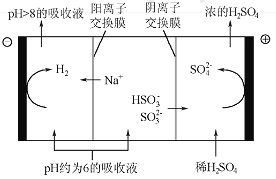
①HSO3-在阳极放电的电极反应式是_______________。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:__________
【题目】I、“蓝天白云”是现代城市人向往的目标,而机动车尾气已成为城市大气的主要污染源,机动车尾气中的主要有害物质为氮的氧化物目前科技工作者正在探索用甲烷等燃料气体将氮氧化物还原为N2和水,涉及到的反应有:
CH4(g)+4NO2(g) =4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+2NO2(g) =CO2(g)+2H2O(g)+N2(g) ΔH2=-867 kJ·mol-1
写出CH4还原NO生成N2的热化学方程式: ____________
Ⅱ、一定温度下,在三个体积均为2.0L的恒容密闭容器中分别加入一定量的X发生反应:
pX(g)Y(g)+Z(g)相关数据如下表所示:
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
X(g) | Y(g) | Z(g) | ||
A | 387 | 0.20 | 0.080 | 0.080 |
B | 387 | 0.40 | 0.160 | 0.160 |
C | T | 0.20 | 0.090 | 0.090 |
回答下列问题:
(1)若容器A中反应经10min达到平衡,则前10min内Y的平均反应速率v(Y)=___________。容器A和容器B中起始时X的反应速率v(X)A___________v(X)B(填“大于”“小于”或“等于”)。
(2)已知该正反应为放热反应,则T___________387(填“大于”或“小于”)。
(3)容器B中X的平衡转化率为___________,若起始时向容器A中充入0.1molX、0.15molY和0.10molZ,则反应将向___________(填“正”或“逆”)反应方向进行,判断理由是_____________________________________________________
Ⅲ、科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置实现了用CO2和H2O合成CH4下列关于该太电池的叙述错误的是____________

A.电池工作时,是将太阳能转化为电能
B.铜电极为正极,电极反应式为:CO2+8e-+8H+=CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
D.为提高该人工光合系统的工作效率,可向装置中加入少量硝酸溶液