题目内容
【题目】下列各项叙述中不正确的是( )
A.10℃时NaCl溶解度为35.7 g,则此时饱和NaCl溶液的质量分数小于35.7%
B.向Na2CO3溶液中加入少量NaHCO3固体,溶液pH减小
C.50 mL1.0 mol·L-1盐酸与60 mL 1.0 mol·L-1盐酸分别跟50 mL 1.1 mol·L-1的 NaOH溶液进行反应,中和热数值不相等
D.一定条件下,向水中加入少量Na2SO4,可使水的电离程度减小
【答案】C
【解析】
A.10℃时NaCl溶解度为35.7 g,则此时饱和NaCl溶液的质量分数为![]() <35.7%,A正确;
<35.7%,A正确;
B.Na2CO3溶液中存在如下平衡:CO32-+H2O![]() HCO3-+OH-,加入少量NaHCO3固体,平衡逆向移动,c(OH-)减小,溶液pH减小,B正确;
HCO3-+OH-,加入少量NaHCO3固体,平衡逆向移动,c(OH-)减小,溶液pH减小,B正确;
C.中和热是指生成1molH2O(l)时放出的热量,与参加反应的H+、OH-的物质的量无关, C不正确;
D.Na2SO4溶液呈中性,对水的电离程度不产生影响,D正确;
故选C。

【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的轨道表示式为_________,基态S原子电子占据最高能级的电子云轮廓图为________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是____________。
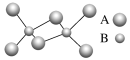
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为___________。
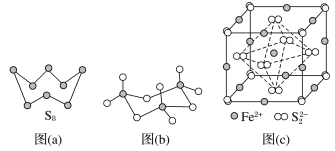
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为____________形,其中共价键的类型有________种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为__________。
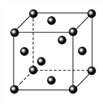
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为______g·cm-3。